题目内容
19.工业制硫酸的流程如下所示: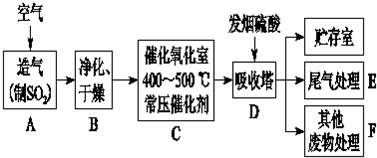
(1)早期以硫铁矿为原料造气,方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,若消耗了12g FeS2上述反应有1.1mol电子发生了转移.
(2)如今多改用固体硫为原料,同时生产过程中送入过量的空气,该改进从减少污染物的排放和提高原料的利用率两个方面体现“绿色化学”.
(3)如果C装置中生成0.1mol SO3,可放出9.83kJ的热量.则该反应的热化学方程式为SO2(g)+$\frac{1}{2}$O2(g)═SO3(g)△H=-98.3kJ/mol.
(4)硫酸厂尾气处理的流程如下:
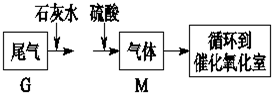
G和M的主要成分一样,如此处理的目的是富集SO2.G与石灰水反应的离子方程式为SO2+Ca2++2OH-═CaSO3↓+H2O.
(5)其他废弃物F中可能含有砷(三价砷离子)元素,处理工艺过程是在含砷废水中加入一定数量的硫酸亚铁,然后加碱调pH至8.5~9.0,反应温度90℃,鼓风氧化,废水中的砷、铁以砷酸铁沉淀析出,写出该过程的离子方程式4As3++4Fe2++3O2+20OH-$\frac{\underline{\;\;△\;\;}}{\;}$4FeAsO4↓+10H2O.
分析 工业制硫酸常用原料为硫铁矿、硫等,通入空气生成二氧化硫,二氧化硫经净化、干燥,在催化作用下生成三氧化硫,吸收塔D中用浓硫酸吸收三氧化硫,可得发烟硫酸,尾气、废弃物需经处理方可排放.
(1)反应4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2中,Fe元素化合价由+2价升高到+3价,S元素化合价由-1价升高到+4价;
(2)如用硫为原料,燃烧生成二氧化硫,利用率较高;
(3)生成0.1mol SO3,可放出9.83kJ的热量,则生成1molSO3放出98.3 kJ,以此书写热化学方程式;
(4)尾气中含有二氧化硫,与石灰水反应生成亚硫酸钙,与硫酸反应生成硫酸钙和二氧化硫,可起到富集的目的;
(5)可结合电荷守恒、电荷守恒书写离子方程式.
解答 解:(1)12g FeS2的物质的量为,n(FeS2)=$\frac{12g}{120g/mol}$=0.1mol,反应4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2中,Fe元素化合价由+2价升高到+3价,S元素化合价由-1价升高到+4价,则0.1molFeS2共失去电子的物质的量为0.1mol×[(3-2)+2×(4-(-1)]=1.1mol,
故答案为:1.1;
(2)如用硫为原料,燃烧生成二氧化硫,可减少废弃物的排放,且利用率较高,故答案为:提高原料的利用率;
(3)生成0.1mol SO3,可放出9.83kJ的热量,则生成1molSO3放出98.3 kJ,热化学方程式为SO2(g)+$\frac{1}{2}$O2(g)═SO3(g)△H=-98.3 kJ/mol,
故答案为:SO2(g)+$\frac{1}{2}$O2(g)═SO3(g)△H=-98.3 kJ/mol;
(4)尾气中含有二氧化硫,与石灰水反应生成亚硫酸钙,反应的离子方程式为SO2+Ca2++2OH-═CaSO3↓+H2O,与硫酸反应生成硫酸钙和二氧化硫,可起到富集的目的,
故答案为:富集SO2;SO2+Ca2++2OH-═CaSO3↓+H2O;
(5)在含砷废水中加入一定数量的硫酸亚铁,然后加碱调pH至8.5~9.0,反应温度90℃,鼓风氧化,废水中的砷、铁以砷酸铁沉淀析出,反应的离子方程式为4As3++4Fe2++3O2+20OH-$\frac{\underline{\;\;△\;\;}}{\;}$4FeAsO4↓+10H2O,
故答案为:4As3++4Fe2++3O2+20OH-$\frac{\underline{\;\;△\;\;}}{\;}$4FeAsO4↓+10H2O.
点评 本题考查物质的制备,为高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握相关物质的性质以及热化学方程式的书写,题目有利于培养学生良好的科学素养,提高学习的积极性,难度中等.

 智慧小复习系列答案
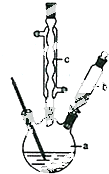
智慧小复习系列答案(1)实验室利用反应TiO2(s)+2CCl4(g)═TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下
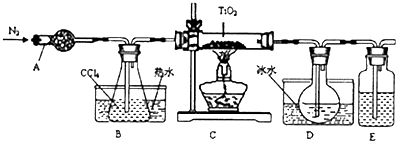
有关性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(2)反应结束后依次进行如下操作:①熄灭酒精灯②停止通氮气③冷却至室温.正确的顺序为①③②(填序号).
(3)D中的液态混合物成分是CCl4和TiCl4,要分离混合物所采用操作的名称是蒸馏.
| A. | 过滤、蒸发、结晶、溶解 | B. | 溶解、蒸发、结晶、过滤 | ||
| C. | 溶解、蒸发、过滤、结晶 | D. | 溶解、过滤、蒸发、结晶 |
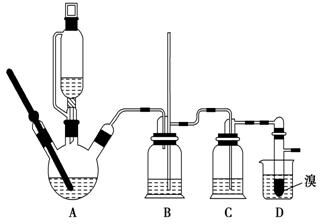 实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2+H2O CH2═CH2+Br2→BrCH2CH2Br
实验室制备1,2二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2═CH2+H2O CH2═CH2+Br2→BrCH2CH2Br可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2二溴乙烷的装置如图所示.
有关数据列表如下:
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d(填正确选项前的字母).
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母).
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去.
(4)将1,2二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”).
(5)若产物中有少量未反应的Br2,最好用b洗涤除去(填正确选项前的字母).
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用蒸馏的方法除去.
(7)反应过程中应用冷水冷却装置D,其主要目的是冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
| 物质 | 熔点 | 沸点 | 水溶性 | 相对分子质量 |
| 乙二醇 | -12.9℃ | 197.3℃ | 溶于水、醇 | 62 |
| 甲醇 | -97℃ | 64.7℃ | 与水互溶 | 32 |
| 草酸二甲酯 | 54℃ | 163.5℃ | 微熔于冷水,溶于醇和醚 | 118 |
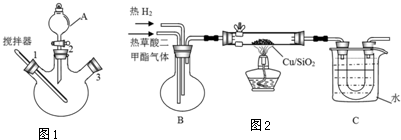
实验室用图1所示装置模拟草酸二甲酯的制备:
步骤1:先往三颈烧瓶中加入甲醇,然后通过A在搅拌器工作时缓慢加入浓硫酸,混合液冷却后,再加入草酸;
步骤2:将A换为球形冷凝管,在3处塞上温度计,在一定的温度下回流2-3小时;
步骤3:将混合液冷凝分离得到草酸二甲酯.
(二)乙二醇的制取
实验室用图2所示的装置模拟工业乙二醇的制取(夹持设备和部分加热装置省略)
反应方程式为:
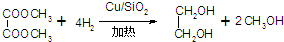
回答下列问题:
(1)仪器A的名称为分液漏斗,步骤3中首个操作是将混合物与冷水混合,则“混合”的正确操作是将混合物沿杯壁慢慢注入装有冷水的烧杯(或容器)中,并不断搅拌.
(2)装置B的作用是使草酸二甲酯和氢气混合均匀.烧杯C中水的温度不能低于55℃,原因是温度低于55℃,未反应的草酸二甲酯会凝结堵塞导管.
(3)对粗产品(主要含乙二醇、草酸二甲酯和甲醇)进行精制,蒸馏收集197.3℃(197℃左右即可)℃的馏分.
(4)实验过程中,使用了16g H2和59g草酸二甲酯,最后得到乙二醇为12.4g,乙二醇的产率为40%.
(5)设计实验证明乙二醇为二元醇:取62g乙二醇,加入足量金属钠充分反应,收集并测量生成的氢气的质量是2g(或其他合理答案,乙二醇与氢气的量符合正确比例即可).
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
 | 1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀, 4.黄绿色褪去 |
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是碱性、漂白性.
(3)该同学推测现象1的白雾由HCl小液滴形成,并进行如下实验验证:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀.
①实验a的目的是检验白雾中是否含有Cl2,排除Cl2干扰.
②有同学认为由实验a、b不能判断白雾中含有HCl,理由是白雾中含有SO2,SO2可以使酸化的AgNO3溶液产生白色沉淀
(4)将A瓶中混合物过滤、洗涤,得到沉淀X.
①向沉淀X中加入稀HCl,无明显变化.取上层液体加氯化钡生成白色沉淀,则沉淀X是CaSO4
②用离子方程式解释现象4中黄绿色褪去的原因:Cl2+SO2+2H2O=4H++2Cl-+SO42-.