��Ŀ����
9��������ͭ�Ǻϳ��������������в���--��������ͭ����Ҫǰ����֮һ������������һ��ʵ���Һϳ�·�ߣ�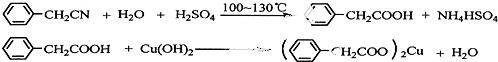
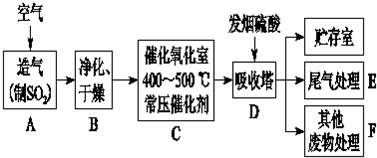
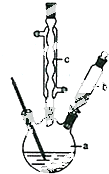
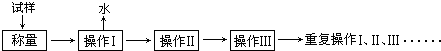
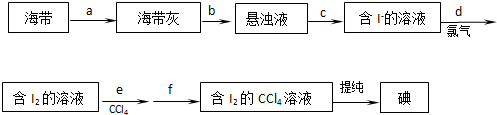
�Ʊ��������װ��ʾ��ͼ���£����Ⱥͼг�װ�õ��ԣ���
��֪����������۵�Ϊ76.5�棬������ˮ�������Ҵ���
�ش��������⣺
��1����250mL����ƿa�м���70mL70%���ᣮ���ƴ�����ʱ����������ˮ��Ũ������Ⱥ�˳�����ȼ�ˮ���ټ���Ũ���ᣮ
��2����a�е���Һ������100�棬�����μ�40g�����浽������Һ�У�Ȼ��������130�������Ӧ����װ���У�����b�������ǵμӱ����棻����c�����������������ܣ��������ǻ�������ʹ�����ķ�ӦҺ��������
��Ӧ�������������ˮ���ٷ�����������Ʒ��������ˮ��Ŀ���DZ��ڱ��������������������п����ڷ��뱽�����Ʒ����BCE�����ţ���
A����Һ©�� B��©��C���ձ�D��ֱ��������E��������
��3���ᴿ�ֱ�����ķ������ؽᾧ�����յõ�44g��Ʒ��������IJ�����95%��
��4����CuCl2•2H2O��NaOH��Һ�Ʊ�����Cu��OH��2�����������������ˮϴ�ӳ������жϳ���ϴ�ɾ���ʵ�������������ȡ���һ������ϴ��Һ������ϡ���ᣬ�ټ���AgNO3��Һ���ް�ɫ���dz��֣�
��5������������˵��Ҵ���ˮ�Ļ���ܼ��У�����ܽ����Cu��OH��2����30min�����ˣ���Һ����һ��ʱ�䣬����������ͭ���壬����ܼ����Ҵ������������������ܽ�ȣ����ڳ�ַ�Ӧ��
���� ��1�����ƴ�����ʱ��Ӧ���ܶȴ��ע���ܶ�С��Һ���У���ֹ���ʱ�ų���ʹҺ�ηɽ���
��2����ͼ��֪��cΪ�����ܣ�ʹ������Һ����������������b�ɼ��뷴ӦҺ����Ӧ�������������ˮ�������¶ȣ���С��������ܽ�ȣ����뱽�����Ʒ�����ù��˲�����
��3��������������ˮ����ˮ�е��ܽ�Ƚ�С���ɷ�Ӧ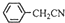 +H2O+H2SO4 $\stackrel{100-130��}{��}$
+H2O+H2SO4 $\stackrel{100-130��}{��}$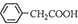 +NH4HSO4��֪��40g���������ɱ�����Ϊ40g��$\frac{136}{117}$=46.5g��
+NH4HSO4��֪��40g���������ɱ�����Ϊ40g��$\frac{136}{117}$=46.5g��
��4��������ˮϴ�ӳ�������������ϴ�Ӹɾ�����������������ϴ��Һȷ���Ƿ�ϴ�Ӹɾ���
��5��������������ˮ�������Ҵ�������ܼ����Ҵ�������������ܽ�ȣ�
��� �⣺��1��ϡ��Ũ����ų��������ȣ����ƴ�����ʱ��Ӧ���ܶȴ��ע���ܶ�С��Һ���У���ֹ���ʱ�ų���ʹҺ�ηɽ������������ˮ��Ũ������Ⱥ�˳�����ȼ�ˮ���ټ���Ũ���ᣬ
�ʴ�Ϊ���ȼ�ˮ���ټ���Ũ���
��2����ͼ��֪��cΪ���������ܣ�������Ϊ��������ʹ�����ķ�ӦҺ������������b������Ϊ�μӱ����棻��Ӧ�������������ˮ�������¶ȣ���С��������ܽ�ȣ��������ˮ�ɱ��ڱ��������������뱽�����Ʒ�����ù��˲���������Ҫ������Ϊ©�����ձ�����������
�ʴ�Ϊ���μӱ����棻���������ܣ���������ʹ�����ķ�ӦҺ�����������ڱ�����������BCE��
��3��������������ˮ����ˮ�е��ܽ�Ƚ�С�����ᴿ������ķ������ؽᾧ���ɷ�Ӧ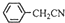 +H2O+H2SO4 $\stackrel{100-130��}{��}$
+H2O+H2SO4 $\stackrel{100-130��}{��}$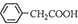 +NH4HSO4��֪��40g���������ɱ�����Ϊ40g��$\frac{136}{117}$=46.5g�����յõ�44g��Ʒ��������IJ����� $\frac{44g}{46.5g}$��100%=95%��
+NH4HSO4��֪��40g���������ɱ�����Ϊ40g��$\frac{136}{117}$=46.5g�����յõ�44g��Ʒ��������IJ����� $\frac{44g}{46.5g}$��100%=95%��
�ʴ�Ϊ���ؽᾧ��95%��
��4��������ˮϴ�ӳ�������������ϴ�Ӹɾ�����������������ϴ��Һȷ���Ƿ�ϴ�Ӹɾ��������ϴ�ɾ���ʵ�������������ȡ���һ������ϴ��Һ������ϡ���ᣬ�ټ���AgNO3��Һ���ް�ɫ���dz��֣�
�ʴ�Ϊ��ȡ���һ������ϴ��Һ������ϡ���ᣬ�ټ���AgNO3��Һ���ް�ɫ���dz��֣�
��5��������������ˮ�������Ҵ�������ܼ����Ҵ�������������ܽ�ȣ�Ȼ����Cu��OH��2��Ӧ��ȥ�����ᣬ������ܼ����Ҵ������������������ܽ�ȣ����ڳ�ַ�Ӧ���ʴ�Ϊ�����������ܽ�ȣ����ڳ�ַ�Ӧ��
���� ����Ϊ2014������߿���ѧ���⣬���������Ʊ�ʵ�鼰�л������ʵĿ��飬���պϳɷ�Ӧ��ʵ��װ�õ�����Ϊ���Ĺؼ����ۺϿ���ѧ��ʵ�鼼�ܺͷ�������������������Ŀ�Ѷ��еȣ�ע����Ϣ�Ĵ�����Ӧ�ã�

 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д�| A�� | ��ķ�� | B�� | ���� | C�� | ¬ɪ�� | D�� | ���ʿ� |
| A�� | ��ϩ�ͼ��鶼�ܷ����ӳɷ�Ӧ | |
| B�� | ú���͡�ʯ�͡������Ͷ������� | |
| C�� | ���顢��ϩ��������ͨ��ʯ�ͷ���õ� | |
| D�� |  + +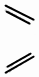 $\stackrel{��}{��}$ $\stackrel{��}{��}$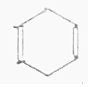 ��Ӧ���ڼӳɷ�Ӧ ��Ӧ���ڼӳɷ�Ӧ |
| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
| n��NO����mol�� | 0.020 | 0.010 | 0.009 | 0.008 | 0.008 | 0.008 |
��2���ﵽƽ��ʱv��NO��Ϊ0.002mol/��L��s����
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����be��
a��v��NO2��=2v��O2�� b��������ѹǿ���ֲ���
c��NO��O2��NO2��Ũ��֮��Ϊ2��1��2 d���������ܶȱ��ֲ���
e���������������ɫ���ٱ仯��
| A�� | ������ܶȷ����˱仯 | B�� | �����ƽ�������������˱仯 | ||
| C�� | �������ɫ�����˱仯 | D�� | ��ϵ���¶ȷ����˱仯 |
�ش��������⣺
��1��������ʵ���п����õ��ļ�������������ͼ�·�������д���������ƣ�
a��
 ������ƽ b��
������ƽ b��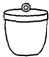 ���� c��
���� c��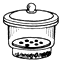 ������ d��
������ d��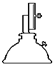 �ƾ����
�ƾ�����١�����I������������ͭ���壬�õ�����bd������ţ�������
�ڡ������IJ�������ȴ��������c������ţ��н��У�
��2�����ظ���������Ϊ���ز�����
�жϴﵽ���ص��������������γ�����������С��0.001g��
���к��ز�����Ŀ����ȷ������ʧȥȫ���ᾧˮ��
��3��ijѧ��ʵ���õ��Ա����ݣ�
| ����ǰ���� | ���Ⱥ����� | |
| m1�������� | m2������+���壩 | m3������+��ˮ����ͭ�� |
| 5.200g | 7.900g | 6.900g |
�ڸ�ѧ���ⶨ���ƫ�ߣ��ƫ�ߡ�����ƫ�͡�����ȷ������
�۴����з�����ѡ����ѧ������ʵ������ԭ������ǣ�����ţ�c��
a��û�н��к��ز���
b�����ȹ��嵽��ɫ��¶���ڿ�������ȴ
c�����ȹ����о�����������ʧ
d�����Ⱥ��ڸ���������ȴ�����º������
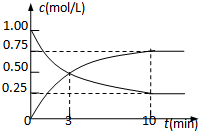 Ϊʵ�֡����ܼ��š��͡���̼���á���һ���������ν�CO2ת��Ϊ��������Դ��Ŀǰ����ҵ�ϳ���CO2������ȼ�ϼ״����ֽ�������ʵ�飺�����Ϊl L���ܱպ��������У�����l mol CO2��3mol H2��һ�������·�����Ӧ��
Ϊʵ�֡����ܼ��š��͡���̼���á���һ���������ν�CO2ת��Ϊ��������Դ��Ŀǰ����ҵ�ϳ���CO2������ȼ�ϼ״����ֽ�������ʵ�飺�����Ϊl L���ܱպ��������У�����l mol CO2��3mol H2��һ�������·�����Ӧ��