题目内容
10.TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料.(1)实验室利用反应TiO2(s)+2CCl4(g)═TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下
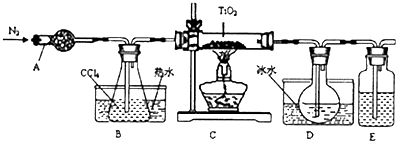
有关性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(2)反应结束后依次进行如下操作:①熄灭酒精灯②停止通氮气③冷却至室温.正确的顺序为①③②(填序号).
(3)D中的液态混合物成分是CCl4和TiCl4,要分离混合物所采用操作的名称是蒸馏.
分析 仪器A是干燥管,因为TiCl4遇到水蒸气会水解,反应前通入氮气的目的是排除装置内的空气,B中利用热水使四氯化碳挥发进入装置C和TiO2反应,TiO2(s)+2CCl4(g)═TiCl4(g)+CO2(g),生成的TiCl4气体进入装置D,冰水浴中冷却得到四氯化钛,E中可以用浓硫酸来隔离空气,
(1)在无水无氧条件下,制取TiCl4,通入氮气赶净装置内空气,防止空气中水蒸气和四氯化钛发生反应;
(2)组装仪器、检验气密性、加装药品,发生反应,终止实验时为防止倒吸,应先熄灭酒精灯,冷却到室温后再停止通入N2,使用冰水混合物的目的是冷却TiCl4气体,
(3)分离两种沸点不同的液体混合物应该用蒸馏,D中的液态混合物为TiCl4与未反应的CCl4,二者互溶,分离互溶的液体采取蒸馏方法.
解答 解:(1)在无水无氧条件下,制取TiCl4,通入氮气赶净装置内空气排除装置内的空气(或水蒸气和氧气),
故答案气为:排除装置内的空气(或水蒸气和氧气);
(2)对于气体的制取性质实验应该:组装仪器、检验气密性、加装药品,发生反应,终止实验时为防止倒吸,应先熄灭酒精灯,冷却到室温后再停止通入N2;
故答案为:②③①;
(3)表中数据和性质可知,D中的液态混合物为TiCl4与未反应的CCl4,二者互溶,但CCl4和TiCl4是两种沸点差异较大的液体混合物,应该用蒸馏进行分离,
故答案为:CCl4和TiCl4;蒸馏.
点评 本题考查实验制备方案,明确原理是解题关键,侧重考查学生装置的分析评价,注意对题目信息的提取与应用,是对学生综合能力的考查,题目难度中等.

练习册系列答案
相关题目
3.下列说法正确的是( )
| A. | 乙烯和甲烷都能发生加成反应 | |
| B. | 煤焦油、石油、花生油都属于烃 | |
| C. | 甲烷、乙烯、苯都可通过石油分馏得到 | |
| D. |  + +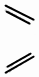 $\stackrel{△}{→}$ $\stackrel{△}{→}$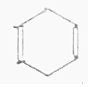 反应属于加成反应 反应属于加成反应 |
1.测定硫酸铜晶体(CuSO4•xH2O)结晶水含量的实验流程如下:
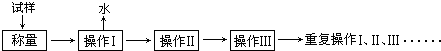
回答下列问题:
(1)以下是实验中可能用到的几种仪器,请在图下方横线上写出仪器名称.
a. 电子天平 b.
电子天平 b. 坩埚 c.
坩埚 c. 干燥器 d.
干燥器 d. 酒精喷灯
酒精喷灯
①“操作I”是灼烧硫酸铜晶体,用到上述bd(填序号)仪器.
②“操作Ⅱ”的操作是冷却,必须在c(填序号)中进行.
(2)“重复操作Ⅰ、Ⅱ、Ⅲ”,称为恒重操作.
判断达到恒重的依据是相邻两次称量的质量差小于0.001g;
进行恒重操作的目的是确保晶体失去全部结晶水.
(3)某学生实验后得到以表数据:
①根据以上数据计算该硫酸铜晶体中结晶水x的值为5.2(精确到0.1).
②该学生测定结果偏高(填“偏高”、“偏低”或“正确”).
③从下列分析中选出该学生产生实验误差的原因可能是(填序号)c.
a.没有进行恒重操作
b.加热固体到白色后,露置在空气中冷却
c.加热过程中晶体有少量溅失
d.加热后在干燥器中冷却至室温后称量.

回答下列问题:
(1)以下是实验中可能用到的几种仪器,请在图下方横线上写出仪器名称.
a.
 电子天平 b.
电子天平 b. 坩埚 c.
坩埚 c. 干燥器 d.
干燥器 d. 酒精喷灯
酒精喷灯①“操作I”是灼烧硫酸铜晶体,用到上述bd(填序号)仪器.
②“操作Ⅱ”的操作是冷却,必须在c(填序号)中进行.
(2)“重复操作Ⅰ、Ⅱ、Ⅲ”,称为恒重操作.
判断达到恒重的依据是相邻两次称量的质量差小于0.001g;
进行恒重操作的目的是确保晶体失去全部结晶水.
(3)某学生实验后得到以表数据:
| 加热前质量 | 加热后质量 | |
| m1(容器) | m2(容器+晶体) | m3(容器+无水硫酸铜) |
| 5.200g | 7.900g | 6.900g |
②该学生测定结果偏高(填“偏高”、“偏低”或“正确”).
③从下列分析中选出该学生产生实验误差的原因可能是(填序号)c.
a.没有进行恒重操作
b.加热固体到白色后,露置在空气中冷却
c.加热过程中晶体有少量溅失
d.加热后在干燥器中冷却至室温后称量.
5.工业制硫酸的一种工艺流程如图1所示:

请回答下列问题:
(1)煅烧前需将黄铁矿粉碎,其目的是充分燃烧,提高原料的利用率.
(2)煅烧造气过程中,若每生成1molSO2气体放出427.5kJ热量,煅烧反应的热化学反应方程式是4FeS2(s)+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g)△H=-3412kJ/mol.
(3)催化氧化是一个可逆反应,下表是不同条件下的SO2平衡的转化率:
根据上表数据,你认为SO2的催化氧化反应实际生产过程中应选择的条件是温度在400°C左右、压强为1MPa.
(4)吸收尾气过程常用NaOH溶液来吸收SO2,若在30L 0.1mol•L-1 的NaOH溶液中通入标准状况下44.8L SO2气体,其反应的离子方程式为3OH-+2SO2=SO32-+HSO3-+H2O,反应后的溶液pH<7,则溶液中离子浓度由大到小的顺序是c(Na+)>c(SO32-)>c(HSO3-)>c(H+)>c(OH-).
(5)另一种将SO2转化为硫酸的化工流程如图2.其中催化剂a表面的反应是SO2+2H2O-2e-═SO42-+4H+,该流程理论上参加反应的SO2与加入的H2O的质量比为8:15.

请回答下列问题:
(1)煅烧前需将黄铁矿粉碎,其目的是充分燃烧,提高原料的利用率.
(2)煅烧造气过程中,若每生成1molSO2气体放出427.5kJ热量,煅烧反应的热化学反应方程式是4FeS2(s)+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g)△H=-3412kJ/mol.
(3)催化氧化是一个可逆反应,下表是不同条件下的SO2平衡的转化率:
| SO2的转化率% | 0.1MPa | 1MPa | 10MPa |
| 400°C | 99.2 | 99.7 | 99.9 |
| 600°C | 73.7 | 89.5 | 96.4 |
(4)吸收尾气过程常用NaOH溶液来吸收SO2,若在30L 0.1mol•L-1 的NaOH溶液中通入标准状况下44.8L SO2气体,其反应的离子方程式为3OH-+2SO2=SO32-+HSO3-+H2O,反应后的溶液pH<7,则溶液中离子浓度由大到小的顺序是c(Na+)>c(SO32-)>c(HSO3-)>c(H+)>c(OH-).
(5)另一种将SO2转化为硫酸的化工流程如图2.其中催化剂a表面的反应是SO2+2H2O-2e-═SO42-+4H+,该流程理论上参加反应的SO2与加入的H2O的质量比为8:15.
20.化学与科学、技术、生活、环境密切相关,下列叙述正确的是( )
| A. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| B. | 高锰酸钾溶液、酒精、过氧化钠都能杀菌消毒,消毒原理相同,都利用了强氧化性 | |
| C. | “加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是对应的单质分子,而钙、铁则指的是对应的钙离子和铁离子 | |
| D. | PM2.5是指大气中直径接近2.5微米的颗粒物,入肺影响健康,这种颗粒物分散空气中形成胶体,它具有丁达尔现象 |
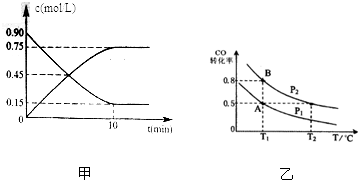
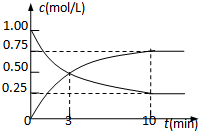 为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:
为实现“节能减排”和“低碳经济”的一项课题是如何将CO2转化为可利用资源.目前,工业上常用CO2来生产燃料甲醇.现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应: