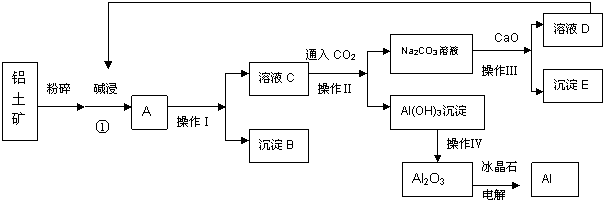
题目内容
10.化学与生活紧密联系,下列说法不正确的是( )| A. | Na2SiO3水溶液俗称水玻璃,可用作木材防火剂 | |
| B. | Fe3O4俗称铁红,可用作红色涂料 | |
| C. | Na2CO3俗称纯碱,可作为制造玻璃的原料 | |
| D. | KAl(SO4)2•12H2O俗称明矾,可作为净水剂 |
分析 A.硅酸钠熔点高,可用于阻燃剂;
B.氧化铁俗称铁红,可用于作油漆、红色涂料;
C.碳酸钠俗称纯碱或苏打,是白色固体,广泛用于玻璃、造纸等工业;
D.明矾溶于水发生水解反应,生成氢氧化铝胶体,氢氧化铝胶体可以吸附杂质.
解答 解:A.硅酸钠熔点高,可用于阻燃剂,可防止木材燃烧,故A正确;
B.氧化铁俗称铁红,可用于作油漆、红色涂料,不是四氧化三铁,故B错误;
C.制造普通玻璃的原料是纯碱(Na2CO3)、石灰石(CaCO3)和石英(SiO2),碳酸钠俗称纯碱,故C正确;
D.明矾[KAl(SO4)2•12H2O]作为净水剂是因为明矾溶于水发生水解反应,生成氢氧化铝胶体,氢氧化铝胶体可以吸附杂质,反应的离子方程式为:Al3++3H2O=Al(OH)3(胶体)+3H+,故D正确;
故选B.
点评 本题考查化学与生活紧密联系的知识,掌握钠、硅、铝及其化合物的知识是解答关键,题目难度不大.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
1.下列现象与氢键无关的是( )
①NH3的熔、沸点比VA族其他元素氢化物的熔、沸点高
②小分子的醇、羧酸可以和水以任意比互溶
③邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的熔、沸点低
④水分子高温下也很稳定⑤水分子较硫化氢分子稳定.
①NH3的熔、沸点比VA族其他元素氢化物的熔、沸点高
②小分子的醇、羧酸可以和水以任意比互溶
③邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的熔、沸点低
④水分子高温下也很稳定⑤水分子较硫化氢分子稳定.
| A. | ①②③④ | B. | ④⑤ | C. | ③④⑤ | D. | ①②③ |
5.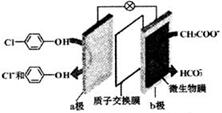 利用微生物电池处理含乙酸钠和对氯酚(
利用微生物电池处理含乙酸钠和对氯酚(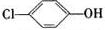 )的废水,工作原理如图所示.下列说法正确的是( )
)的废水,工作原理如图所示.下列说法正确的是( )
 利用微生物电池处理含乙酸钠和对氯酚(
利用微生物电池处理含乙酸钠和对氯酚( )的废水,工作原理如图所示.下列说法正确的是( )
)的废水,工作原理如图所示.下列说法正确的是( )| A. | 电极b是正极 | B. | 质子从a极移向b极 | ||
| C. | 处理后的废水pH升高 | D. | a极的电极反应式: |
15.X、Y、Z、W是原子序数依次增大的短周期元素,X最高正价与最低负价的代数和为零,Y、Z易形成质量比为3:4和3:8的两种常见化合物,含W元素的物质其焰色反应为黄色.下列说法正确的是( )
| A. | 常见单质的沸点:W>Y>Z | |
| B. | W的氢化物为共价化合物 | |
| C. | 原子半径:Y<Z<W | |
| D. | X、Y可以形成既有极性键也有非极性键的化合物 |
2.环境问题已经是我国面临的重大问题.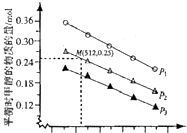
Ⅰ.减少二氧化碳的排放是一项重要课题.研究表明,C02经催化加氢可合成低碳醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H几种化学键的键能如表所示
通过计算得出△H=-28kJ/mol.
(2)在1.0L恒容密闭容器中投入lmolC02和2.75molH2发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
当压强为P2,温度为512K时,向该容器中投入 lmol CO2、0.5mol H2、2mol CH3OH、0.6mol H20时,平衡向逆反应方向移动.
(3)以CH3OH、空气(02含量20%)、KOH溶液为 原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O;用该 电池电解500mL 1mol/L CuSO4溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量1mol.
Ⅱ.SO2也是一种大气污染物,可以用海水处理含SO2的废气,海水中主要离子的含量如下:
(1)海水经初步处理后,还含有Ca2+、Mg2+,Na+、Cl-,向其中加入石灰浆使海水中的Mg2+转换 为Mg(OH)2,当Mg2+刚好沉淀完全时,c( Ca2+)为4.58mol/L
已知Ksp[Mg(OH)2]=1.2×l0-11 Ksp[Ca(OH)2]=5.5×10-6
(2)处理过的废气中S02的含量可以通过碘量法来测定.用到的试剂有:0.l mol•L的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟aL(标况下)的流速通入到lOOmL含有淀粉的碘标准液中,t min达到滴定终点.滴定终点的现象为溶液蓝色褪去,且半分钟不恢复颜色计算该处理气中SO2的含量$\frac{0.224}{at}$(用含a,t的式子表示)

Ⅰ.减少二氧化碳的排放是一项重要课题.研究表明,C02经催化加氢可合成低碳醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H几种化学键的键能如表所示
| 化学键 | C=0 | H-H | C-C | C-H | 0-H | C-0 |
| 键能/kJ•mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
(2)在1.0L恒容密闭容器中投入lmolC02和2.75molH2发生该反应,实验测得不同温度及压强下,平衡时甲醉的物质的量如图所示.
当压强为P2,温度为512K时,向该容器中投入 lmol CO2、0.5mol H2、2mol CH3OH、0.6mol H20时,平衡向逆反应方向移动.
(3)以CH3OH、空气(02含量20%)、KOH溶液为 原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O;用该 电池电解500mL 1mol/L CuSO4溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量1mol.
Ⅱ.SO2也是一种大气污染物,可以用海水处理含SO2的废气,海水中主要离子的含量如下:
| 成分 | 含量/(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3-; | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
已知Ksp[Mg(OH)2]=1.2×l0-11 Ksp[Ca(OH)2]=5.5×10-6
(2)处理过的废气中S02的含量可以通过碘量法来测定.用到的试剂有:0.l mol•L的碘标准溶液,淀粉溶液.当把处理后的废气以每分钟aL(标况下)的流速通入到lOOmL含有淀粉的碘标准液中,t min达到滴定终点.滴定终点的现象为溶液蓝色褪去,且半分钟不恢复颜色计算该处理气中SO2的含量$\frac{0.224}{at}$(用含a,t的式子表示)
4.(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量642kJ(25℃时),N2H4完全燃烧的热化学方程式是:N2H4(l)+O2(g)=N2(g)+2H2O(1)△H=-642.0kJ/mol.
(2)在高温下一氧化碳可将二氧化硫还原为单质硫.
①C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol
②CO2(g)+C(s)=2CO(g)△H2=+172.5kJ•mol
③S(s)+O2(g)=SO2(g)△H3=-296.0kJ•mol
则CO与SO2反应的热化学方程式是2CO(g)+SO2(g)=CO2(g)+S(s)△H=-270kJ/mol.
(3)硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O.下列各组实验中最先出现浑浊的是D(填字母代号).
(4)已知H+(aq)+OH-(aq)═H2O(1)△H=-57.3kJ/mol,实验室用0.25L0.10mol/L的一元强酸和强碱恰好完全中和,若中和后溶液体积为500mL,其溶液的比热容为4.2×10-3kJ/(g•℃),且密度近似为1.0g/mL,则溶液温度升高了0.68℃.(结果保留两位小数)
(2)在高温下一氧化碳可将二氧化硫还原为单质硫.
①C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol
②CO2(g)+C(s)=2CO(g)△H2=+172.5kJ•mol
③S(s)+O2(g)=SO2(g)△H3=-296.0kJ•mol
则CO与SO2反应的热化学方程式是2CO(g)+SO2(g)=CO2(g)+S(s)△H=-270kJ/mol.
(3)硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O.下列各组实验中最先出现浑浊的是D(填字母代号).
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
 .
. 表示的分子式为C6H14;名称是2-甲基戊烷.
表示的分子式为C6H14;名称是2-甲基戊烷.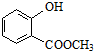 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.