题目内容
16.下列叙述中,正确的是( )| A. | 第三周期元素的离子半径从左到右逐渐减小 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | ⅥA族元素的氢化物中,稳定性最好的其还原性最强 | |
| D. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 |
分析 A.第三周期元素金属离子半径小于非金属的离子半径;
B.ⅥA族元素的原子,其半径越大,非金属性越弱;
C.ⅥA族元素的氢化物中,稳定性越强,对应的元素的非金属性越强;
D.IA族可为H或金属等元素.
解答 解:A.第三周期元素金属离子核外有2个电子层,半径小于非金属的离子半径,故A错误;
B.ⅥA族元素的原子,其半径越大,非金属性越弱,越难以得到电子,故B错误;
C.ⅥA族元素的氢化物中,稳定性越强,对应的元素的非金属性越强,氢化物的还原性越弱,故C错误;
D.IA族可为H或金属等元素,可与卤族元素形成共价化合物或离子化合物,故D正确.
故选D.
点评 本题考查元素周期表和元素周期律,为高频考点,侧重于学生的分析能力的考查,熟悉元素性质的变化规律及单质的性质即可解答,难度不大.

练习册系列答案
相关题目
6.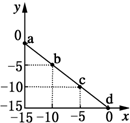 某温度下的溶液中c(H+)=10xmol/L,c(OH-)=10ymol/L.x与y的关系如图所示:下列说法正确的是( )
某温度下的溶液中c(H+)=10xmol/L,c(OH-)=10ymol/L.x与y的关系如图所示:下列说法正确的是( )
 某温度下的溶液中c(H+)=10xmol/L,c(OH-)=10ymol/L.x与y的关系如图所示:下列说法正确的是( )
某温度下的溶液中c(H+)=10xmol/L,c(OH-)=10ymol/L.x与y的关系如图所示:下列说法正确的是( )| A. | 该温度高于25℃ | |
| B. | 图中a点溶液呈碱性 | |
| C. | 该温度下,0.01 mol•L-1的HCl溶液中,由水电离出的H+浓度为10-12 mol•L-1 | |
| D. | 该温度下,等体积浓度均为0.01 mol•L-1的HCl溶液与NaOH溶液恰好完全反应的pH=7 |
7.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 标准状况下,2.24 L CCl4中含有的分子数为0.1NA | |
| B. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.4NA | |
| C. | 28 g聚乙烯含有的碳原子数为2n NA | |
| D. | 常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数为0.4 NA |
4.常温下,将pH=8的NaOH与pH=10的NaOH溶液等体积混合后,溶液中氢离子浓度最接近( )
| A. | $\frac{1}{2}$(1×10-8+1×10-10)mol/L | B. | (1×10-8+1×10-10)mol/L | ||
| C. | (1×10-14-5×10-5)mol/L | D. | 2×10-10mol/L |
11.下列有关元素的性质及其递变规律正确的是( )
| A. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| B. | 同主族元素的简单阴离子还原性越强,其原子的非金属性越强 | |
| C. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
1.分子式为C7H12O4,其中只含二个-COOCH3基团的同分异构体(不考虑手性异构)共有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
5.下列说法错误的是( )
| A. | 化学反应中的能量变化都表现为热量变化 | |
| B. | 需要加热才能发生的反应不一定是吸热反应 | |
| C. | 外界条件与反应是放热还是吸热没有必然联系 | |
| D. | 反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
6.某元素X的最高价氧化物的水化物的化学式为H2XO4,则其气态氢化物的化学式应为( )
| A. | H2X | B. | H3X | C. | XH4 | D. | HX |