题目内容
7.设NA为阿伏加德罗常数的值,下列说法中正确的是( )| A. | 标准状况下,2.24 L CCl4中含有的分子数为0.1NA | |
| B. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.4NA | |
| C. | 28 g聚乙烯含有的碳原子数为2n NA | |
| D. | 常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数为0.4 NA |
分析 A.标况下四氯化碳为液体;
B.0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1mol一氧化氮;
C.聚乙烯的最简式为CH2,28g聚乙烯中含有最简式2mol,含有2mol碳原子;
D.葡萄糖和冰醋酸最简式相同为CH2O,只需要计算3.0gCH2O的物质的量计算原子数.
解答 解:A.标准状况下,2.24 L CCl4为液体不能使用气体摩尔体积,故A错误;
B.标况下,6.72L二氧化氮的物质的量为0.3mol,0.3mol二氧化氮与水反应生成了0.1mol一氧化氮,转移了0.2mol电子,转移的电子数目为0.2NA,故B错误;
C.28g聚乙烯中含有2mol最简式CH2,所以28g混合物中含有2mol碳原子,含有的碳原子数为2NA,故C错误;
D.葡萄糖和冰醋酸最简式相同为CH2O,只需要计算3.0gCH2O的物质的量计算原子数=$\frac{3.0g}{30g/mol}$×4×NA=0.4NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积使用条件和对象,题目难度不大.

练习册系列答案
相关题目
9.下列化学反应不能设计成实用电池是( )
| A. | Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O | B. | 2NaOH+CuSO4═Na2SO4+Cu(OH)2↓ | ||
| C. | 2CO+O2═2CO2 | D. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
18.滴定法是化学上常用的定量分析的方法.滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等.
Ⅰ.甲化学兴趣小组取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用0.2000mol•L-1的标准NaOH溶液进行滴定.重复上述滴定操作3次,并记录数据.
(1)滴定时边滴边摇动锥形瓶,眼睛应观察B.(填序号)
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(2)判断滴定终点的现象是:溶液从无色变为浅红色,且半分钟内不变色.
(3)根据下列数据:请计算待测盐酸溶液的浓度为0.2000mol/L.
Ⅱ.乙化学兴趣小组利用氧化还原反应滴定,测定了某工厂废水中游离态氯的含量.实验如下:
①取水样10.0ml于锥形瓶中,加入10.0ml的KI溶液(足量),滴入指示剂2~3滴.
②将自己配制的0.01mol•L-1标准Na2S2O3溶液装入滴定管中,调整液面,记下读数.
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+2Na2S4O6.试回答下列问答:
(1)步骤①发生的化学反应方程式为:Cl2+KI=I2+2KCl;加入的指示剂是淀粉溶液.
(2)步骤②应使用碱式滴定管.
(3)氯的所测浓度比实际浓度会偏大,造成误差的原因可能是ACE(填序号)
A 配制标准Na2S2O3溶液定容时,加水超过刻度线
B 锥形瓶水洗后直接装待测水样
C 装标准Na2S2O3溶液的滴定管水洗后没有润洗
D 滴定到达终点时,俯视读出滴定管读数;
E 滴定前尖嘴部分有气泡,滴定后消失
Ⅲ.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下表,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
(1)滴定时,你认为该滴定适宜选用的指示剂是下列中的D.(填序号)
A.KBrB.KIC.K2S D.K2CrO4
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(Br-)}{c(Cl-)}$=2.7×10-3.
Ⅰ.甲化学兴趣小组取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用0.2000mol•L-1的标准NaOH溶液进行滴定.重复上述滴定操作3次,并记录数据.
(1)滴定时边滴边摇动锥形瓶,眼睛应观察B.(填序号)
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(2)判断滴定终点的现象是:溶液从无色变为浅红色,且半分钟内不变色.
(3)根据下列数据:请计算待测盐酸溶液的浓度为0.2000mol/L.
| 滴定次数 | 待测液体积(mL) | 标准NaOH溶液读数记录(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
①取水样10.0ml于锥形瓶中,加入10.0ml的KI溶液(足量),滴入指示剂2~3滴.
②将自己配制的0.01mol•L-1标准Na2S2O3溶液装入滴定管中,调整液面,记下读数.
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+2Na2S4O6.试回答下列问答:
(1)步骤①发生的化学反应方程式为:Cl2+KI=I2+2KCl;加入的指示剂是淀粉溶液.
(2)步骤②应使用碱式滴定管.
(3)氯的所测浓度比实际浓度会偏大,造成误差的原因可能是ACE(填序号)
A 配制标准Na2S2O3溶液定容时,加水超过刻度线
B 锥形瓶水洗后直接装待测水样
C 装标准Na2S2O3溶液的滴定管水洗后没有润洗
D 滴定到达终点时,俯视读出滴定管读数;
E 滴定前尖嘴部分有气泡,滴定后消失
Ⅲ.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下表,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 | 2.0×10-48 | 2.0×10-12 |
A.KBrB.KIC.K2S D.K2CrO4
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(Br-)}{c(Cl-)}$=2.7×10-3.
15. 酸碱中和滴定是中学化学中重要的定量实验之一.某研究性学习小组准确进行了如下实验,称取1.00g不纯的苛性钠样品配成250ml溶液,取出10.00ml,用已知浓度为0.040mol•L-1的盐酸进行滴定(杂质不与盐酸反应).
酸碱中和滴定是中学化学中重要的定量实验之一.某研究性学习小组准确进行了如下实验,称取1.00g不纯的苛性钠样品配成250ml溶液,取出10.00ml,用已知浓度为0.040mol•L-1的盐酸进行滴定(杂质不与盐酸反应).
根据要求回答下列问题:
(1)配制250mL 0.040mol•L-1的盐酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为测定该苛性钠样品的纯度,几次滴定消耗盐酸的体积如下:
该苛性钠样品的纯度=80%.
(3)若操作过程中未用盐酸润洗滴定管,则测定结果将偏大(填“偏大”、“偏小”或“无影响”).
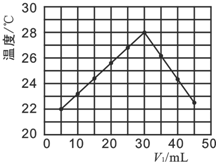
(4)在另一次实验中,研究性小组将V1 mL 1.0mol•L-1 HCl溶液和V2 mL 未知浓度的NaOH溶液均匀混合后,测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).
下列叙述中正确的是b.
a、该实验的环境温度为22℃
b、当V1=40时,溶液中c(Na+)<c(Cl-)
c、NaOH溶液的浓度为1.0mol•L-1
d、保持其他条件不变,只将HCl改为CH3COOH进行实验,也得到如图的实验结果.
 酸碱中和滴定是中学化学中重要的定量实验之一.某研究性学习小组准确进行了如下实验,称取1.00g不纯的苛性钠样品配成250ml溶液,取出10.00ml,用已知浓度为0.040mol•L-1的盐酸进行滴定(杂质不与盐酸反应).
酸碱中和滴定是中学化学中重要的定量实验之一.某研究性学习小组准确进行了如下实验,称取1.00g不纯的苛性钠样品配成250ml溶液,取出10.00ml,用已知浓度为0.040mol•L-1的盐酸进行滴定(杂质不与盐酸反应).根据要求回答下列问题:
(1)配制250mL 0.040mol•L-1的盐酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和250mL容量瓶.
(2)为测定该苛性钠样品的纯度,几次滴定消耗盐酸的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗盐酸溶液的体积(mL) | 20.05 | 20.00 | 22.10 | 19.95 |
(3)若操作过程中未用盐酸润洗滴定管,则测定结果将偏大(填“偏大”、“偏小”或“无影响”).
(4)在另一次实验中,研究性小组将V1 mL 1.0mol•L-1 HCl溶液和V2 mL 未知浓度的NaOH溶液均匀混合后,测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).
下列叙述中正确的是b.
a、该实验的环境温度为22℃
b、当V1=40时,溶液中c(Na+)<c(Cl-)
c、NaOH溶液的浓度为1.0mol•L-1
d、保持其他条件不变,只将HCl改为CH3COOH进行实验,也得到如图的实验结果.
2.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6 NA | |
| B. | 1.5 mol NO2与足量水反应,转移的电子数为1.5 NA | |
| C. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA | |
| D. | 常温常压下,11.2 L Cl2含氯原子数为NA |
12.用标准NaOH溶液滴定未知浓度的盐酸溶液,以测定盐酸的浓度,下列操作使测定结果偏高的是( )
| A. | 未知浓度盐酸用滴定管量取,该滴定管用蒸馏水洗涤后未用待测液润洗 | |
| B. | 装待测液的锥形瓶,洗涤后未干就盛入待测液 | |
| C. | 滴定结束后,用俯视法观察碱式滴定管刻度,其余操作正确 | |
| D. | 滴定结束后,发现碱式滴定管尖嘴处悬挂一滴碱液 |
16.下列叙述中,正确的是( )
| A. | 第三周期元素的离子半径从左到右逐渐减小 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | ⅥA族元素的氢化物中,稳定性最好的其还原性最强 | |
| D. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 |
17.下列说法正确的是( )
| A. | SiO2与酸、碱均不反应 | |
| B. | NO2溶于水时发生氧化还原反应 | |
| C. | SO2具有氧化性,可用于漂白纸浆 | |
| D. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 |