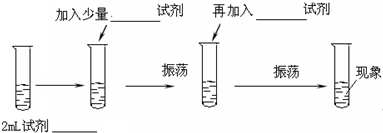
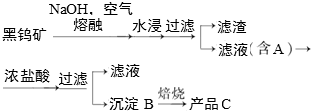
题目内容
8.某有机物0.3克完全燃烧后生成224毫升(标准状况)二氧化碳和0.18克水.已知该物质的蒸气对氢气的相对密度为30,试求:(1)有机物的分子式.
(2)试写出该有机物可能的结构简式并命名.
分析 n(CO2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,n(H2O)=$\frac{0.18g}{18g/mol}$=0.01mol,该物质的蒸气对氢气的相对密度为30,则该有机物的相对分子质量为30×2=60,
6g有机物物质的量$\frac{0.3g}{60g/mol}$=0.005mol,结合原子守恒及质量守恒推断有机物.
解答 解:n(CO2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,n(H2O)=$\frac{0.18g}{18g/mol}$=0.01mol,该物质的蒸气对氢气的相对密度为30,则该有机物的相对分子质量为30×2=60,
6g有机物物质的量$\frac{0.3g}{60g/mol}$=0.005mol,
由原子守恒可知,有机物中C原子个数为$\frac{0.01mol}{0.005mol}$=2,H原子个数为$\frac{0.01mol×2}{0.005mol}$=4,O原子个数为$\frac{\frac{0.3g-0.01mol×12g/mol-0.01mol×2×1g/mol}{16g/mol}}{0.005mol}$=2,
(1)由上述计算可知,1个分子中含2个C、4个H、2个O,则分子式为C2H4O2,
答:有机物的分子式为C2H4O2;
(2)分子式C2H4O2符合羧酸及饱和酯的通式,可能为CH3COOH(乙酸)或HCOOCH3(甲酸甲酯),
答:该有机物可能的结构简式及命名为CH3COOH(乙酸)或HCOOCH3(甲酸甲酯).
点评 本题考查有机物的推断及分子式计算确定,为高频考点,把握守恒法推断分子式及有机物的结构为解答的关键,侧重分析与推断能力、计算能力的考查,题目难度不大.

 名校课堂系列答案
名校课堂系列答案Ⅰ.甲化学兴趣小组取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用0.2000mol•L-1的标准NaOH溶液进行滴定.重复上述滴定操作3次,并记录数据.
(1)滴定时边滴边摇动锥形瓶,眼睛应观察B.(填序号)
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(2)判断滴定终点的现象是:溶液从无色变为浅红色,且半分钟内不变色.
(3)根据下列数据:请计算待测盐酸溶液的浓度为0.2000mol/L.
| 滴定次数 | 待测液体积(mL) | 标准NaOH溶液读数记录(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
①取水样10.0ml于锥形瓶中,加入10.0ml的KI溶液(足量),滴入指示剂2~3滴.
②将自己配制的0.01mol•L-1标准Na2S2O3溶液装入滴定管中,调整液面,记下读数.
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+2Na2S4O6.试回答下列问答:
(1)步骤①发生的化学反应方程式为:Cl2+KI=I2+2KCl;加入的指示剂是淀粉溶液.
(2)步骤②应使用碱式滴定管.
(3)氯的所测浓度比实际浓度会偏大,造成误差的原因可能是ACE(填序号)
A 配制标准Na2S2O3溶液定容时,加水超过刻度线
B 锥形瓶水洗后直接装待测水样
C 装标准Na2S2O3溶液的滴定管水洗后没有润洗
D 滴定到达终点时,俯视读出滴定管读数;
E 滴定前尖嘴部分有气泡,滴定后消失
Ⅲ.沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下表,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 | 2.0×10-48 | 2.0×10-12 |
A.KBrB.KIC.K2S D.K2CrO4
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(Br-)}{c(Cl-)}$=2.7×10-3.
| A. | 第三周期元素的离子半径从左到右逐渐减小 | |
| B. | ⅥA族元素的原子,其半径越大,越容易得到电子 | |
| C. | ⅥA族元素的氢化物中,稳定性最好的其还原性最强 | |
| D. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 |
| A. | 溶解合金时收集到NO气体体积为2.24L(在标准状况) | |
| B. | 加入合金的质量不可能为9.6g | |
| C. | 沉淀完全时消耗NaOH溶液的体积为150mL | |
| D. | 参加反应的硝酸的物质的量为0.4mol |
| A. | SiO2与酸、碱均不反应 | |
| B. | NO2溶于水时发生氧化还原反应 | |
| C. | SO2具有氧化性,可用于漂白纸浆 | |
| D. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 |

| A. | 甲中负极反应式为Zn-2e-═Zn2+ | |
| B. | 乙中阳极反应式为Ag-e-═Ag+ | |
| C. | 丙中H+向碳棒方向移动 | |
| D. | 丁中电解开始时阳极产生黄绿色气体 |