题目内容
10.实验室用密度为1.25g•mL-1,溶质质量分数为36.5%的浓盐酸配制240mL 0.1mol•L-1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为12.5mol/L.)
(2)配制240mL 0.1mol•L-1的盐酸
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
A.用30mL水洗涤2~3次,洗涤液均注入容量瓶,振荡
B.用5mL准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡、摇匀
E.改用胶头滴管加水,使溶液凹液面最低处恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处
(4)操作A中,将洗涤液都移入容量瓶,其目的是洗涤液中含有少量的溶质,为避免溶质的量的减少,应将洗涤液全部转移到容量瓶中
(5)若实验过程中出现如下情况如何处理?
①加蒸馏水时不慎超过了刻度线:重新配制.
②向容量瓶中转移溶液时不慎有液滴溅在容量瓶外面:重新配制.
(6)若实验遇到下列情况,溶液的浓度是偏高,偏低还是不变?
A.定容时仰视刻度线偏低;
B.忘记将洗涤液加入容量瓶偏低;
C.容量瓶内壁附有水珠而未干燥处理不变;
D.溶解后没有冷却便进行定容偏高.
分析 (1)根据c=$\frac{1000ρω}{M}$计算该盐酸的物质的量浓度;
(2)依据溶液稀释规律:稀释前后含的溶质的物质的量不变计算需要浓溶液的体积,依据配制溶液体积选择容量瓶规格;
(3)依据配制一定物质的量浓度溶液的一般步骤排序解答;
(4)烧杯和玻璃棒上都沾有硫酸,洗涤液中含有少量的溶质,为避免溶质的量的减少,应将洗涤液全部转移到容量瓶中;
(5)凡是导致实验失败的操作且不能补救的都必须重新配制溶液;
(6)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行判断.
解答 解:(1)密度为1.25g•mL-1,溶质质量分数为36.5%的浓盐酸的物质的量浓度C=$\frac{1000×1.25×36.5%}{36.5}$=12.5mol/L;
故答案为:12.5mol/L;
(2)配制240mL 0.1mol•L-1的盐酸,应选择250mL容量瓶,设需要浓盐酸体积为V,则依据溶液稀释规律:稀释前后含的溶质的物质的量不变,V×12.5mol/L=250mL×0.1mol/L,解得V=2.0mL;
故答案为:2.0;250;
(3)配制一定物质的量浓度溶液的一般步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶,所以正确顺序为:BCAFED;
B.量取2.0mL盐酸,需要用5mL量筒;
E、F.定容时,继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处,改用胶头滴管加水,使溶液凹液面最低处恰好与刻度线相切;
故答案为:BCAFED;5mL;胶头滴管;1-2cm;
(4)烧杯和玻璃棒上都沾有硫酸,洗涤液中含有少量的溶质,为避免溶质的量的减少,应将洗涤液全部转移到容量瓶中.
故答案为:洗涤液中含有少量的溶质,为避免溶质的量的减少,应将洗涤液全部转移到容量瓶中;
(5)①加蒸馏水时不慎超过了刻度线,实验失败且不能补救,必须重新配制;
②向容量瓶中转移溶液时不慎有液滴溅在容量瓶外面,实验失败且不能补救,必须重新配制;
故答案为:重新配制;重新配制;
(6)A.定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏低;
B.忘记将洗涤液加入容量瓶,导致溶质的物质的量偏小,溶液浓度偏低;
C.容量瓶内壁附有水珠而未干燥处理,对溶质的物质的量和溶液的体积都不会产生影响,溶液浓度不变;
D.溶解后没有冷却便进行定容,冷却后,溶液体积偏小,溶液浓偏高;
故答案为:偏低;偏低;不变;偏高.
点评 本题考查了一定物质的量浓度溶液的配制,明确配置原理和操作步骤是解题关键,注意误差分析的方法和技巧.

| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B:KNO3;D:CuSO4.
(2)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3.
(3)写出实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═[Al(OH)4]-.
(4)C常用作净水剂,用离子方程式表示其净水原理:Al3++3H2O?Al(OH)3(胶体)+3H+.
| A. | 1.43g/L | B. | 1.90g/L | C. | 2.14g/L | D. | 2.38g/L |
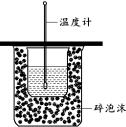 下列实验操作正确的是( )
下列实验操作正确的是( )| A. | 用图装置测定中和热 | |
| B. | 将同浓度的FeCl3溶液和CuSO4溶液分别滴入H2O2中,滴入FeCl3溶液的H2O2更快产生气泡.不能得出结论对H2O2分解的催化效果Fe3+>Cu2+ | |
| C. | 研究H+浓度对该平衡:Cr2O72-+H2?2CrO42-+2H+的影响,往5mL 0.1mol/L K2CrO4溶液加入5mL 0.1mol/L的稀硫酸 | |
| D. | 测定溶液的pH值时,用玻璃棒蘸取少量溶液点在湿润的pH试纸上再与标准比色卡对照 |
| A. | 同物质的量浓度的三种溶液的pH:a=b>c | |
| B. | 同pH时,三种溶液稀释相同倍数后,pH:a=b<c | |
| C. | 同pH、同体积的三种溶液消耗同浓度盐酸的体积:a=b=c | |
| D. | 同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c |