题目内容
19. 下列实验操作正确的是( )
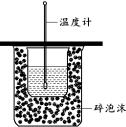
下列实验操作正确的是( )| A. | 用图装置测定中和热 | |
| B. | 将同浓度的FeCl3溶液和CuSO4溶液分别滴入H2O2中,滴入FeCl3溶液的H2O2更快产生气泡.不能得出结论对H2O2分解的催化效果Fe3+>Cu2+ | |
| C. | 研究H+浓度对该平衡:Cr2O72-+H2?2CrO42-+2H+的影响,往5mL 0.1mol/L K2CrO4溶液加入5mL 0.1mol/L的稀硫酸 | |
| D. | 测定溶液的pH值时,用玻璃棒蘸取少量溶液点在湿润的pH试纸上再与标准比色卡对照 |
分析 A.缺少环形玻璃棒;
B.滴入FeCl3溶液产生的气泡更快些,说明催化效果好;
C.应加入浓硫酸;
D.PH试纸要用干燥的,若湿润后相当于降低了溶液浓度.
解答 解:A.缺少搅拌装置环形玻璃棒,故A错误;
B.滴入FeCl3溶液产生的气泡更快些,说明催化效果好,可证明催化效果Fe3+>Cu2+,故B正确;
C.硫酸的浓度较小,应加入浓硫酸,故C错误;
D.PH试纸要用干燥的,测定溶液PH时不可湿润,否则相当于降低了溶液的浓度,故D错误.
故选B.
点评 本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
7.下列变化需要加还原剂才能实现的是( )
| A. | MnO2→MnCl2 | B. | Fe→Fe2+ | C. | Cl-→Cl2 | D. | SO2→H2SO3 |
10.实验室用密度为1.25g•mL-1,溶质质量分数为36.5%的浓盐酸配制
240mL 0.1mol•L-1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为12.5mol/L.)
(2)配制240mL 0.1mol•L-1的盐酸
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)BCAFED.
A.用30mL水洗涤2~3次,洗涤液均注入容量瓶,振荡
B.用5mL准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡、摇匀
E.改用胶头滴管加水,使溶液凹液面最低处恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处
(4)操作A中,将洗涤液都移入容量瓶,其目的是洗涤液中含有少量的溶质,为避免溶质的量的减少,应将洗涤液全部转移到容量瓶中
(5)若实验过程中出现如下情况如何处理?
①加蒸馏水时不慎超过了刻度线:重新配制.
②向容量瓶中转移溶液时不慎有液滴溅在容量瓶外面:重新配制.
(6)若实验遇到下列情况,溶液的浓度是偏高,偏低还是不变?
A.定容时仰视刻度线偏低;
B.忘记将洗涤液加入容量瓶偏低;
C.容量瓶内壁附有水珠而未干燥处理不变;
D.溶解后没有冷却便进行定容偏高.
240mL 0.1mol•L-1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为12.5mol/L.)
(2)配制240mL 0.1mol•L-1的盐酸
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
A.用30mL水洗涤2~3次,洗涤液均注入容量瓶,振荡
B.用5mL准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡、摇匀
E.改用胶头滴管加水,使溶液凹液面最低处恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处
(4)操作A中,将洗涤液都移入容量瓶,其目的是洗涤液中含有少量的溶质,为避免溶质的量的减少,应将洗涤液全部转移到容量瓶中
(5)若实验过程中出现如下情况如何处理?
①加蒸馏水时不慎超过了刻度线:重新配制.
②向容量瓶中转移溶液时不慎有液滴溅在容量瓶外面:重新配制.
(6)若实验遇到下列情况,溶液的浓度是偏高,偏低还是不变?
A.定容时仰视刻度线偏低;
B.忘记将洗涤液加入容量瓶偏低;
C.容量瓶内壁附有水珠而未干燥处理不变;
D.溶解后没有冷却便进行定容偏高.
11.下列叙述一定正确的是( )
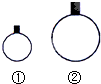

| A. | 常温常压下,相同物质的量的物质,其体积一定相等 | |
| B. | 常温常压下,用等质量的H2、CH4两种气体分别吹出如图所示的两个气球,其中①号气球内气体一定为CH4 | |
| C. | 任何条件下,等物质的量的氮气和一氧化碳所含的分子数、原子数不一定相等 | |
| D. | 1mol金属镁与其他物质发生化学反应,金属镁失去的电子数一定是2NA |
8.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1mol丙烯酸含有NA个不饱和键 | |
| B. | 标准状况下,11.2L的苯中含有3NA个碳氢键 | |
| C. | 0.1mol/L的Na3PO4溶液中含有的阴离子总数大于0.1NA | |
| D. | 1L1.0mol/L的Na2SiO3溶液中含有的氧原子数目大于3NA |
9.在溶液导电性实验装置里在相同温度下分别注入20mL 6mol•L-1醋酸和20mL6mol•L-1氨水,灯光明暗程度相同,如果把这两种溶液混和后再试验则( )
| A. | 灯光变暗;二者电离常数相同 | B. | 灯光变暗;电离常数醋酸大于氨水 | ||
| C. | 灯光变亮;电离常数醋酸小于氨水 | D. | 灯光变亮;电离常数醋酸等于氨水 |
 ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.
ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.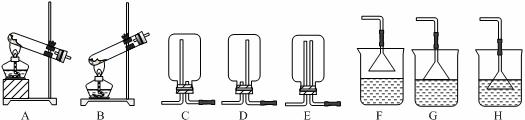
 2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.
2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.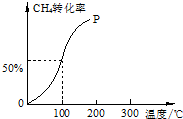 以CH4和H2O为原料,通过下列反应来制备甲醇.
以CH4和H2O为原料,通过下列反应来制备甲醇.