题目内容
17.某实验小组以工业碳酸钙(含有少量NaCl、Al2O3、Fe2O3、SiO2等杂质,不考虑其他杂质)生产二水合氯化钙的主要流程如下: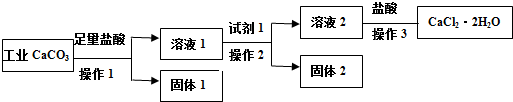
下列说法不正确的是( )
| A. | 试剂1可以是适量的氢氧化钙固体或适量的氧化钙固体 | |
| B. | 欲检验溶液2中是否含有Fe3+,可取少量溶液,滴加KSCN溶液,若溶液无明显现象,则不含有Fe3+ | |
| C. | 若用已知浓度AgNO3溶液来滴定产品(加入某指示剂)中的氯离子来测量产品纯度,计算所得的数据不可能大于100.0% | |
| D. | 若改变方案,在溶液2中加入适量的碳酸铵,得到的沉淀用盐酸溶解、酸化后进行操作3,可得到纯度更高的二水合氯化钙 |
分析 二氧化硅与盐酸不反应,工业碳酸钙加入盐酸,得到溶液1含有Al3+、Fe3+、Ca2+,固体1为SiO2,在溶液1中加入氢氧化钙,可生成Al(OH)3、Fe(OH)3,即固体2,溶液2含有氯化钙、氢氧化钙,加入盐酸,蒸发浓缩、冷却结晶可得到CaCl2•2H2O,以此解答该题.
解答 解:二氧化硅与盐酸不反应,工业碳酸钙加入盐酸,得到溶液1含有Al3+、Fe3+、Ca2+,固体1为SiO2,在溶液1中加入氢氧化钙,可生成Al(OH)3、Fe(OH)3,即固体2,溶液2含有氯化钙、氢氧化钙,加入盐酸,蒸发浓缩、冷却结晶可得到CaCl2•2H2O,
A.试剂1用于除去Al3+、Fe3+,且不能引入新杂质,则可以是适量的氢氧化钙固体或适量的氧化钙固体,故A正确;
B.检验铁离子,可用KSCN,根据溶液是否变为红色判断,故B正确;
C.产品中含有氯化钠,加入硝酸银生成更多的氯化银沉淀,则计算所得的数据可能大于100.0%,故C错误;
D.若改变方案,在溶液2中加入适量的碳酸铵,得到碳酸钙沉淀,以与氯化钠分离,用盐酸溶解、酸化后进行操作3,可得到纯度更高的二水合氯化钙,故D正确.
故选C.
点评 本题考查物质的制备,为高考常见题型,侧重于学生的分析、实验能力的考查,题目紧扣生产目的分析生产流程图,明确流程图中各操作在生产过程中的作用,整体把握生产过程,这是解答所提出的问题的基础,难道不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列表示对应化学反应的离子方程式不正确的是( )
| A. | 工业上利用电解饱和食盐水制氯气:2H++2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| B. | 将过量二氧化硫气体通入氨水中:SO2+NH3•H2O═HSO${\;}_{3}^{-}$+NH${\;}_{4}^{+}$ | |
| C. | 用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO${\;}_{3}^{2-}$═CaCO3↓+SO${\;}_{3}^{2-}$ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO${\;}_{3}^{-}$═3Ag++NO↑+2H2O |
5.下列物质转化在给定条件下能实现的是( )
| A. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 | |
| D. | NH3$\stackrel{O_{2}/催化剂}{→}$NO2$\stackrel{H_{2}O}{→}$HNO3 |
12.下列说法正确的是( )
| A. | 青砖(含Fe3O4)中的Fe2+可用浓盐酸溶解后,再加入适量高锰酸钾溶液进行检验 | |
| B. | 用0.1000 mol•L-1 NaOH溶液滴定20.00 mL未知浓度盐酸,接近终点时因滴速太快造成NaOH少许过量;此时若加入一定体积该盐酸后,继续用该NaOH溶液恰好滴定至终点,则测得的盐酸浓度将偏大 | |
| C. | 用镊子夹取金属钠固体,切割取用后剩余的钠放回原试剂瓶中 | |
| D. | 检查容量瓶瓶口是否漏水的方法是:往瓶内加入一定量水,塞好瓶塞.用食指摁住瓶塞,另一只手托住瓶底,把瓶倒转过来,观察瓶塞周围是否有水漏出即可 |
2.下列化学反应的离子方程式正确的是( )
| A. | Ba(OH)2溶液中滴加NH4HSO4溶液至Ba2+沉淀完全:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 将过量SO2气体通入氨水中:SO2+NH3•H2O═NH4++HSO3- | |
| C. | 用醋酸除去水垢中的CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
9.下列有关化学与生活、工业的叙述中,正确的是( )
| A. | 去年12月我国向月球发射的“玉兔号”月亮车,体现了我国航天科技的实力,车上安装的太阳能电池帆板的材料是二氧化硅 | |
| B. | 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质 | |
| C. | 中国食品质量监督局规定,从2011年5月份起,面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,由此说明添加剂均会严重危害人体健康 | |
| D. | 以煤为燃料的工厂、汽车尾气排放物等容易造成雾霾,治理雾霾最好的办法是研制纳米级口罩,以确保肺癌的发病率降低 |