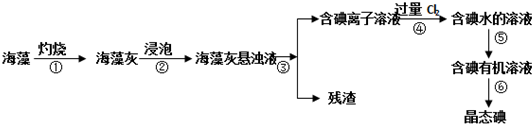
题目内容
7.现代炼锌的方法可分为火法和湿法两大类,俩是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选.焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来.主要反应为:
2ZnS+3O2$\frac{\underline{\;高温\;}}{\;}$2ZnO+2SO2; 鼓风炉中:2C+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CO ZnO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Zn+CO2
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下.实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如图1;硫酸溶液的体积与固体的体积比如图2
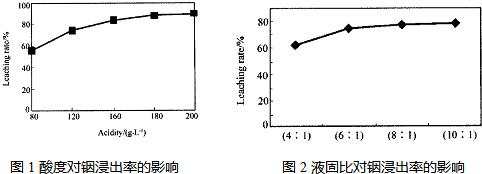
①当酸度为196时,其物质的量浓度为2mol•L-1.
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:180,6:1.
(2)湿法炼锌的主要工艺流程为:

①从保护环境和充分利用原料角度,如何处理或利用烟气将烟道气净化,用于生产硫酸等.
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式Cd2++2OH-=Cd(OH)2↓、Zn2++4OH-=ZnO22-+2H2O[或Zn2++4OH-=Zn(OH)42-].
分析 (1)①根据酸度的定义计算,酸度为196时,说明1L溶液中硫酸的质量为196g,即硫酸为2mol,故浓度为2mol/L;
②根据图象可以看出,当酸度为180或液固比为6:1时,浸出率变化不大;
(2)闪锌矿(主要含ZnS)的焙烧可生成ZnO等,含尘烟气含有含硫氧化物,可用于制备硫酸,焙烧后的固体用硫酸浸取,浸出液进行净化可知硫酸锌溶液,电解硫酸锌溶液可得到锌和硫酸,电解液中含有硫酸,可循环利用,
①闪锌矿主要含ZnS,在焙烧时生成二氧化硫气体,可用于生产硫酸;
②H2O2具有氧化性,在酸性条件下将具有还原性的Fe2+离子氧化成Fe3+离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
③Zn(OH)2和氢氧化铝一样也具有两性,既可与酸反应生成盐和水,又能和碱反应生成盐和水,可根据氢氧化铝的反应来书写.
解答 解:(1)①酸度为196时,说明1L溶液中硫酸的质量为196g,硫酸的物质的量为$\frac{196g}{98g/mol}$=2mol,浓度为2mol/L,故答案为:2mol•L-1;
②由图象可以看出,当酸度为180或液固比为6:1时,浸出率变化不大,从节约原料和浸出率考虑,适宜的酸度和液固比分别为:180; 6:1,故答案为:180; 6:1;
(2)①闪锌矿主要含ZnS,在焙烧时生成二氧化硫气体,如随意排放会污染环境,可用于生产硫酸,故答案为:将烟道气净化,用于生产硫酸等;
②H2O2具有氧化性,在酸性条件下将具有还原性的Fe2+离子氧化成Fe3+离子,反应离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
③根据Zn(OH)2和氢氧化铝一样也具有两性,既可与酸反应生成盐和水,又能和碱反应生成盐和水,酸浸出液还含有Cd2+,为了防止镉污染并回收镉,可加过量的碱溶液,反应分别为:Cd2++2OH-=Cd(OH)2↓;Zn2++4OH-=ZnO22-+2H2O[或Zn2++4OH-=Zn(OH)42-].
故答案为:Cd2++2OH-=Cd(OH)2↓、Zn2++4OH-=ZnO22-+2H2O[或Zn2++4OH-=Zn(OH)42-].
点评 本题以信息题目的形式考查金属冶炼的一般原理,做题时注意题中给予的关键信息,如闪锌矿的组成,酸度等问题,本题较为综合,具有一定难度.

| A. | 碘、氯化铵 | B. | 氯化铵、硫酸钡 | C. | 硫化钠、氯酸钾 | D. | 氯化钠、硫酸钠 |
| A. | 3,4,4-三甲基己烷 | B. | 2-甲基-4-乙基-1-戊烯 | ||
| C. | 2-乙基-1-戊烯 | D. | 2-乙基丁烷 |

部分物质的相关性质如表:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
| SiF4 | -90 | -86 | 易水解 |
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%.
(2)以磷灰石为原料,湿法磷酸过程中Ca3F(PO4)3反应的化学方程式为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑.现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85%的商品磷酸0.49 吨.
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是:CaSiO3(填化学式),冷凝塔1的主要沉积物是:液态白磷,冷凝塔2的主要沉积物是:固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液,可除去SiF4、H2S、HF
再通入次氯酸钠溶液,可除去PH3(均填化学式).
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是:产品纯度高.
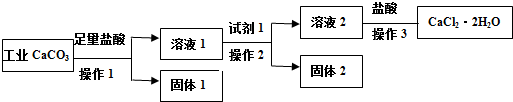
下列说法不正确的是( )
| A. | 试剂1可以是适量的氢氧化钙固体或适量的氧化钙固体 | |
| B. | 欲检验溶液2中是否含有Fe3+,可取少量溶液,滴加KSCN溶液,若溶液无明显现象,则不含有Fe3+ | |
| C. | 若用已知浓度AgNO3溶液来滴定产品(加入某指示剂)中的氯离子来测量产品纯度,计算所得的数据不可能大于100.0% | |
| D. | 若改变方案,在溶液2中加入适量的碳酸铵,得到的沉淀用盐酸溶解、酸化后进行操作3,可得到纯度更高的二水合氯化钙 |

 .
.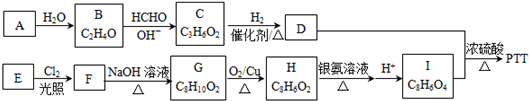
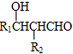
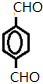 +4Ag(NH3)2OH$\stackrel{水浴}{→}$
+4Ag(NH3)2OH$\stackrel{水浴}{→}$ +4Ag↓+6NH3+2H2O.
+4Ag↓+6NH3+2H2O. .
.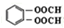 .
.