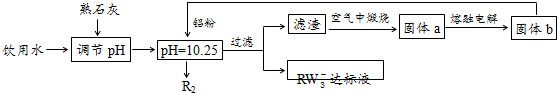
题目内容
8.下列表示对应化学反应的离子方程式不正确的是( )| A. | 工业上利用电解饱和食盐水制氯气:2H++2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| B. | 将过量二氧化硫气体通入氨水中:SO2+NH3•H2O═HSO${\;}_{3}^{-}$+NH${\;}_{4}^{+}$ | |
| C. | 用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO${\;}_{3}^{2-}$═CaCO3↓+SO${\;}_{3}^{2-}$ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:3Ag+4H++NO${\;}_{3}^{-}$═3Ag++NO↑+2H2O |
分析 A.碘生成NaOH、氢气、氯气;
B.反应生成亚硫酸氢铵;
C.水垢中含硫酸钙,发生沉淀的转化生成硫酸钠;
D.发生氧化还原反应,遵循电子、电荷守恒.
解答 解:A.工业上利用电解饱和食盐水制氯气的离子反应为2H2O+2Cl-$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,故A错误;
B.将过量二氧化硫气体通入氨水中的离子反应为SO2+NH3•H2O═HSO3-+NH4+,故B正确;
C.用碳酸钠溶液浸泡锅炉水垢的离子反应为CaSO4+CO32-═CaCO3↓+SO42-,故C错误;
D.用稀硝酸洗涤试管内壁的银镜的离子反应为3Ag+4H++NO3-═3Ag++NO↑+2H2O,故D正确;
故选AC.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应方程式的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
19.磷矿石主要以磷酸钙〔Ca3(PO4)2•H2O〕和磷灰石[Ca5F(PO4)3Ca5(OH)(PO4)3]等形式存在.图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸.图(b)是热法磷酸生产过程中由磷灰石制单质磷的流程.

部分物质的相关性质如表:
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%.
(2)以磷灰石为原料,湿法磷酸过程中Ca3F(PO4)3反应的化学方程式为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑.现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85%的商品磷酸0.49 吨.
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是:CaSiO3(填化学式),冷凝塔1的主要沉积物是:液态白磷,冷凝塔2的主要沉积物是:固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液,可除去SiF4、H2S、HF
再通入次氯酸钠溶液,可除去PH3(均填化学式).
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是:产品纯度高.

部分物质的相关性质如表:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
| SiF4 | -90 | -86 | 易水解 |
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的69%.
(2)以磷灰石为原料,湿法磷酸过程中Ca3F(PO4)3反应的化学方程式为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑.现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85%的商品磷酸0.49 吨.
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是:CaSiO3(填化学式),冷凝塔1的主要沉积物是:液态白磷,冷凝塔2的主要沉积物是:固态白磷.
(4)尾气中主要含有SiF4、CO,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液,可除去SiF4、H2S、HF
再通入次氯酸钠溶液,可除去PH3(均填化学式).
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是:产品纯度高.
3.在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原子称为不对称碳原子(或手性碳原子).具有手性碳原子的有机物具有光学活性.下列分子中,含有两个手性碳原子的是( )
| A. | 乳酸 CH3-CHOH-COOH | |
| B. | 甘油 CH2OH-CHOH-CH2OH | |
| C. | 脱氧核糖 CH2OH-CHOH-CHOH-CH2-CHO | |
| D. | 核糖 CH2OH-CHOH-CHOH-CHOH-CHO |
20.LiAlH4在125℃分解为LiH、H2和Al.下列说法中不正确的是( )
| A. | 乙醛在LiAlH4的作用下生成乙醇,LiAlH4作还原剂 | |
| B. | LiH中两种微粒半径:H->Li+ | |
| C. | 1mol LiAlH4在125℃完全分解,则转移4mol电子 | |
| D. | LiH溶于水的化学反应方程式:LiH+H2O═LiOH+H2↑ |
17.某实验小组以工业碳酸钙(含有少量NaCl、Al2O3、Fe2O3、SiO2等杂质,不考虑其他杂质)生产二水合氯化钙的主要流程如下:
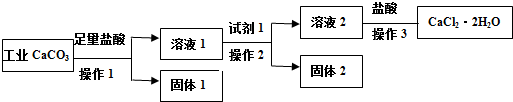
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 试剂1可以是适量的氢氧化钙固体或适量的氧化钙固体 | |
| B. | 欲检验溶液2中是否含有Fe3+,可取少量溶液,滴加KSCN溶液,若溶液无明显现象,则不含有Fe3+ | |
| C. | 若用已知浓度AgNO3溶液来滴定产品(加入某指示剂)中的氯离子来测量产品纯度,计算所得的数据不可能大于100.0% | |
| D. | 若改变方案,在溶液2中加入适量的碳酸铵,得到的沉淀用盐酸溶解、酸化后进行操作3,可得到纯度更高的二水合氯化钙 |
18.在2L0.1mol•L-1 BaCl2溶液中,下列说法正确的是( )
| A. | Cl-物质的量为0.1mol | B. | Cl-物质的量浓度为0.2 mol•L-1 | ||
| C. | Ba2+物质的量为0.1mol | D. | Ba2+物质的量浓度为0.2 mol•L-1 |
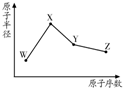 R、W、X、Y、Z是五种常见的短周期元素,其中四种元素的原子半径随原子序数变化如图所示.通常R的单质占空气体积的五分之四左右,W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.
R、W、X、Y、Z是五种常见的短周期元素,其中四种元素的原子半径随原子序数变化如图所示.通常R的单质占空气体积的五分之四左右,W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强. ,R的气态氢化物与其最高价氧化物的水化物反应生成一种化合物,该化合物的水溶液不呈中性的原因是NH4++H2O?NH3.H2O+H+(用离子方程式表示);
,R的气态氢化物与其最高价氧化物的水化物反应生成一种化合物,该化合物的水溶液不呈中性的原因是NH4++H2O?NH3.H2O+H+(用离子方程式表示);