题目内容
7.某烃36g完全燃烧后,得3mol水和2.5mol二氧化碳试求:该有机物的化学式.分析 某烃36g完全燃烧后,得3mol水和2.5mol二氧化碳,可得n(C):n(H)=2.5mol:3mol×2=5:12,可计算实验式,结合碳的成键特点判断化学式,以此解答.
解答 解:某烃36g完全燃烧后,得3mol水和2.5mol二氧化碳,可得n(C):n(H)=2.5mol:3mol×2=5:12,可得实验式为C5H12,此时C原子共价键达到饱和,为饱和烃,所以分子式为C5H12,
答:有机物的化学式为C5H12.
点评 本题考查有机物分子式确定的计算,为高频考点,侧重考查学生分析计算能力,注意烷烃的实验式与分子式的判断,难度不大.

练习册系列答案
相关题目
17.某实验小组以工业碳酸钙(含有少量NaCl、Al2O3、Fe2O3、SiO2等杂质,不考虑其他杂质)生产二水合氯化钙的主要流程如下:
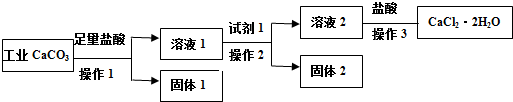
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 试剂1可以是适量的氢氧化钙固体或适量的氧化钙固体 | |
| B. | 欲检验溶液2中是否含有Fe3+,可取少量溶液,滴加KSCN溶液,若溶液无明显现象,则不含有Fe3+ | |
| C. | 若用已知浓度AgNO3溶液来滴定产品(加入某指示剂)中的氯离子来测量产品纯度,计算所得的数据不可能大于100.0% | |
| D. | 若改变方案,在溶液2中加入适量的碳酸铵,得到的沉淀用盐酸溶解、酸化后进行操作3,可得到纯度更高的二水合氯化钙 |
18.在2L0.1mol•L-1 BaCl2溶液中,下列说法正确的是( )
| A. | Cl-物质的量为0.1mol | B. | Cl-物质的量浓度为0.2 mol•L-1 | ||
| C. | Ba2+物质的量为0.1mol | D. | Ba2+物质的量浓度为0.2 mol•L-1 |
15.短周期非金属元素甲~戊在元素周期表中相对位置如下表所示,下列判断不正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:甲>乙 | |
| B. | 原子核外电子层数:乙<丁 | |
| C. | 原子最外层电子数:丙>丁>戊 | |
| D. | 元素的最高价氧化物对应水化物的酸性:丙<戊 |
9.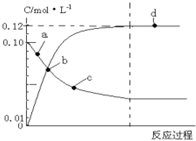 373K时,N2O4(g)?2NO2(g)平衡体系的建立过程中各物质浓度与时间的关系如图,下列说法正确的是( )
373K时,N2O4(g)?2NO2(g)平衡体系的建立过程中各物质浓度与时间的关系如图,下列说法正确的是( )
 373K时,N2O4(g)?2NO2(g)平衡体系的建立过程中各物质浓度与时间的关系如图,下列说法正确的是( )
373K时,N2O4(g)?2NO2(g)平衡体系的建立过程中各物质浓度与时间的关系如图,下列说法正确的是( )| A. | 反应达到a点时,正反应速率大于逆反应速率 | |
| B. | 反应达到b时,表示反应达到平衡 | |
| C. | 反应达到b点时,NO2和 N2O4二者浓度相等 | |
| D. | 反应达到d点时,N2O4的转化率为40% |
10.某实验小组探究工业上废渣(主要成分为Cu2S和Fe2O3)的综合利用,过程如下:
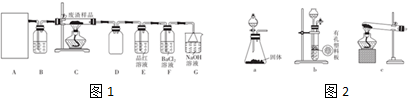
(1)该小组同学设计如图1装置模拟废渣在过量氧气中焙烧,并验证废渣中含有硫元素.
①在实验室中,图2装置可以作为装置A的是ac.
②证明废渣中含有硫元素的实验现象是装置E中品红溶液褪色.
③装置F中生成白色沉淀的离子方程式为2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+.
(2)某同学将上述实验中灼烧后的固体A进行如下操作:
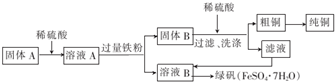
①固体B的成分是Fe、Cu(填化学式).
②由溶液B得到绿矾的过程中应该进行的操作是蒸发浓缩,冷却结晶、过滤、洗涤、干燥.
③为测定产品中绿矾的质量分数,称取30.0g样品配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10mol•L-1的酸性KMnO4溶液进行滴定,反应为10FeSO4+8H2SO4+2KMnO4═2MnSO4+5Fe(SO4)3+K2SO4+8H2O.实验所得数据如表所示.
Ⅰ.第1组实验数据出现异常,造成这种异常的原因可能是ac(填字母).
a.量取绿矾溶液的酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时俯视读数
d.滴定前尖嘴有气泡,滴定后气泡消失
Ⅱ.根据表中数据,产品中绿矾的质量分数为92.7%.

(1)该小组同学设计如图1装置模拟废渣在过量氧气中焙烧,并验证废渣中含有硫元素.
①在实验室中,图2装置可以作为装置A的是ac.
②证明废渣中含有硫元素的实验现象是装置E中品红溶液褪色.
③装置F中生成白色沉淀的离子方程式为2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+.
(2)某同学将上述实验中灼烧后的固体A进行如下操作:

①固体B的成分是Fe、Cu(填化学式).
②由溶液B得到绿矾的过程中应该进行的操作是蒸发浓缩,冷却结晶、过滤、洗涤、干燥.
③为测定产品中绿矾的质量分数,称取30.0g样品配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10mol•L-1的酸性KMnO4溶液进行滴定,反应为10FeSO4+8H2SO4+2KMnO4═2MnSO4+5Fe(SO4)3+K2SO4+8H2O.实验所得数据如表所示.
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗酸性KMnO4溶液的体积/mL | 19.10 | 20.02 | 19.98 | 20.00 |
a.量取绿矾溶液的酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时俯视读数
d.滴定前尖嘴有气泡,滴定后气泡消失
Ⅱ.根据表中数据,产品中绿矾的质量分数为92.7%.
 (1)下列说法中,不正确的是DEHIJ
(1)下列说法中,不正确的是DEHIJ