题目内容
6.甲醛(H2C═O)在Ni催化作用下加氢可得甲醇(CH3OH).甲醇分子内C原子的杂化方式为sp3杂化,甲醇分子内的O-C-H键角小于(填“大于”“等于”或“小于”)甲醛分子内的O-C-H键角.分析 根据价层电子对互斥理论确定中心原子杂化方式,价层电子对个数(n)=配原子个数+孤电子对个数.
根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化;sp3杂化是四面体构型,sp2杂化,分子呈平面三角形.
解答 解:甲醛中C原子形成3个σ键,为sp2杂化,是平面三角形结构,键角为120°,甲醇分子内碳原子形成4个σ键,无孤电子对,杂化方式为sp3杂化,是四面体结构,O-C-H键角约为109°28′,键角小于120°,所以甲醇分子内O-C-H键角比甲醛分子内O-C-H键角小,
故答案为:sp3;小于.
点评 本题考查了原子的杂化方式,题目难度不大,注意把握价层电子对数的判断方法.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案
相关题目
16.茚是从煤油中提取的一种无色透明油状液体,不溶于水,可用于制造合成树脂.其结构简式为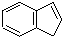 .下列关于茚的说法中不正确的是( )
.下列关于茚的说法中不正确的是( )
 .下列关于茚的说法中不正确的是( )
.下列关于茚的说法中不正确的是( )| A. | 茚能使酸性高锰酸钾溶液褪色 | |
| B. | 茚能使溴的四氯化碳溶液褪色 | |
| C. | 1 mol茚只含有1 mol碳碳双键 | |
| D. | 茚中所有的原子均可能处在同一平面上 |
14.将一定量的钠铝合金置于水中,合金全部溶解,往溶液中加入1mol/L盐酸20mL,此时沉淀量达到最大值,则原合金中钠的质量为( )
| A. | 0.80g | B. | 0.02g | C. | 0.23g | D. | 0.46g |
1.有A、B两种烃,其相关信息如下
回答下列问题:
(1)烃A的最简式是CH;
(2)烃A的结构简式是 ;
;
(3)烃B的3种二溴代物的结构简式为CHBr2CH(CH3)2;CH2BrCBr(CH3)2;CH2BrCH(CH3)CH2Br.
| A | 完全燃烧的产物中n(CO2):n(H2O)=2:1 28<Mr(A)<60 不能使溴的四氯化碳溶液褪色 一氯代物只有1种结构 |
| B | 饱和链烃,通常情况下呈气态 二溴代物有3种 |
(1)烃A的最简式是CH;
(2)烃A的结构简式是
 ;
;(3)烃B的3种二溴代物的结构简式为CHBr2CH(CH3)2;CH2BrCBr(CH3)2;CH2BrCH(CH3)CH2Br.
18.分类是科学研究的重要方法,下列物质分类不正确的是( )
| A. | 化合物:干冰、冰水共存物、烧碱、小苏打 | |
| B. | 非电解质:乙醇、四氯化碳、氯气、葡萄糖 | |
| C. | 同素异形体:活性炭、C60、石墨烯、金刚石 | |
| D. | 混合物:铝热剂、纯净矿泉水、分析纯盐酸、漂白粉 |
 .
.