题目内容
9.40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如图所示.下列说法不正确的是( )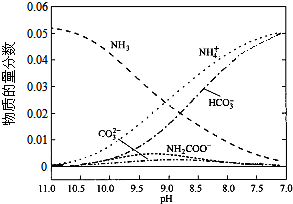
| A. | 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COOˉ)>c(CO32-) | |
| B. | 随着CO2的通入,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| C. | 不同pH的溶液中存在关系:c(NH4+)+c(H+)═2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) | |
| D. | 在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成 |
分析 A.根据pH=9时,图象中各种离子浓度的大小关系分析;
B.根据Kb=$\frac{c(N{H}_{4}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$分析;
C.溶液中存在电荷守恒,即正电荷的总浓度等于负电荷的总浓度;
D.根据图象可知开始没有NH2COO-,后来也不存在NH2COO-.
解答 解:A.pH=9时,图象中各种离子浓度的大小关系:c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-),故A正确;
B.已知Kb=$\frac{c(N{H}_{4}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,温度一定时,Kb为常数,不随浓度的变化而变化,随着CO2的通入,c(NH4+)逐渐增大,则$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断减小,故B错误;
C.溶液中存在电荷守恒,即正电荷的总浓度等于负电荷的总浓度,则不同pH的溶液中存在电荷守恒关系为:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-),故C正确;
D.由图象可知开始没有NH2COO-,后来也不存在NH2COO-,所以NH2COO-为中间产物,即在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成,故D正确.
故选B.
点评 本题考查了溶液中离子浓度大小比较、电荷守恒的应用、图象的分析与应用等,题目难度中等,侧重于考查学生对图象的分析与应用能力.

练习册系列答案
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
19.性质决定用途,下列物质的用途中,利用其物理性质的是( )
| A. | 干冰用作冷冻剂 | B. | 硫酸用于处理碱性废液 | ||
| C. | 氧气用于气焊 | D. | 生石灰用作干燥剂 |
17.下列实验操作中错误的是( )
| A. | 蒸发结晶操作时,当有大量晶体析出时停止加热,用余热蒸干 | |
| B. | 蒸馏操作时,应使温度计水银球插入液态混合物中 | |
| C. | 分液操作时,分液漏斗中下层液体从下口流出,上层液体从上口倒出 | |
| D. | 萃取操作时,萃取剂要和原溶剂互不相溶,且不能与溶质和溶剂反应 |
14.热电池是一种可长期储备电能的电池,高氯酸钾广泛用于热电池.铁和高氯酸钾反应提供的能量使盐熔化导电,从而激活电池.铁和高氯酸钾的热电池反应为KClO4(s)+4Fe(s)═KCl(s)+4FeO(s)△H下列说法正确的是( )
| A. | 正极反应式为KClO4(s)+8e?═KCl(s)+4O2?(l) | |
| B. | 在该热电池中,铁为负极,发生还原反应 | |
| C. | △H参与反应的高氯酸钾越多,其值越小 | |
| D. | 生成1 mol FeO转移8 mol电子 |
19.乙醇和二甲醚在下列哪一种检测仪上显示出的信号是完全相同的( )
| A. | 质谱仪 | B. | 红外光谱仪 | C. | 元素分析仪 | D. | 核磁共振仪 |
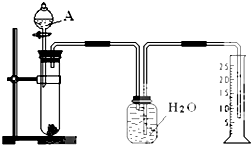 某同学设计了一个简单的实验(如图所示),以测定镁铝合金中铝的质量分数.可供选用的试剂有:浓H2SO4、浓硝酸、6mol•L-1NaOH溶液.请填写下列空白:
某同学设计了一个简单的实验(如图所示),以测定镁铝合金中铝的质量分数.可供选用的试剂有:浓H2SO4、浓硝酸、6mol•L-1NaOH溶液.请填写下列空白: 实验室用如图方法测定某水样中O2的含量.
实验室用如图方法测定某水样中O2的含量.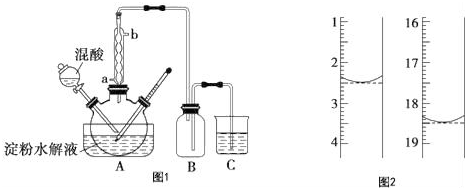
 .
. ,C的最高价氧化物水化物的电子式
,C的最高价氧化物水化物的电子式 ,淡黄色的固体E的电子式
,淡黄色的固体E的电子式 .
.