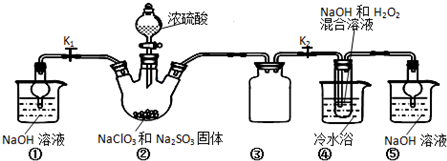
题目内容
19.性质决定用途,下列物质的用途中,利用其物理性质的是( )| A. | 干冰用作冷冻剂 | B. | 硫酸用于处理碱性废液 | ||
| C. | 氧气用于气焊 | D. | 生石灰用作干燥剂 |
分析 物质的化学性质是指在化学变化中表现出来的性质,物质的物理性质是指不需要通过化学变化表现出来的性质,据此进行分析判断.
解答 解:A、干冰升华过程中吸热,所以干冰用作冷冻剂,故A正确;
B、酸碱中和反应是化学性质,故B错误;
C、氧气支持燃烧,是化学性质,故C错误;
D、生石灰用作干燥剂是生石灰与水反应生成氢氧化钙,故D错误;
故选A.
点评 本题难度不大,区分物质的用途是利用了物理性质还是化学性质,关键就是看利用的性质是否需要通过化学变化体现出来.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| B. | 10 mol•L-1的浓氨水:Al3+、NH4+、NO3-、I- | |
| C. | 与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、Na+、AlO2-、CO32- |
14. 表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:
表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:
(1)下列事实能证明②的非金属性比⑦强的是CD
A.Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑
B.SiO2+2C$\frac{\underline{\;高温\;}}{\;}$ Si+2CO↑
C.Na2SiO3+CO2+2H2O═H2SiO3↓+Na2CO3
D.CH4比SiH4稳定
(2)①、④、⑤三种元素组成化合物所含化学键类型有离子键、共价键.
(3)④、⑤、⑥所形成的简单离子半径由大到小的顺序:O2->Na+>Al3+.(用元素符号表示)
(4)①、②、⑧三种元素按原子个数之比为11:5:1组成的有机化合物中含有两个-CH3的同分异构体有4种.
(5)某同学设计实验证明②、③、⑦的非金属性强弱关系.
①溶液a和b分别为硝酸,饱和NaHCO3溶液.
②溶液c中的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-或SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-.
 表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:
表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
A.Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑
B.SiO2+2C$\frac{\underline{\;高温\;}}{\;}$ Si+2CO↑
C.Na2SiO3+CO2+2H2O═H2SiO3↓+Na2CO3
D.CH4比SiH4稳定
(2)①、④、⑤三种元素组成化合物所含化学键类型有离子键、共价键.
(3)④、⑤、⑥所形成的简单离子半径由大到小的顺序:O2->Na+>Al3+.(用元素符号表示)
(4)①、②、⑧三种元素按原子个数之比为11:5:1组成的有机化合物中含有两个-CH3的同分异构体有4种.
(5)某同学设计实验证明②、③、⑦的非金属性强弱关系.
①溶液a和b分别为硝酸,饱和NaHCO3溶液.
②溶液c中的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-或SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-.
8.导致下列环境问题的主要原因与排放SO2有关的是( )
| A. | 酸雨 | B. | 干旱 | C. | 臭氧层空洞 | D. | 温室效应 |
9.40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如图所示.下列说法不正确的是( )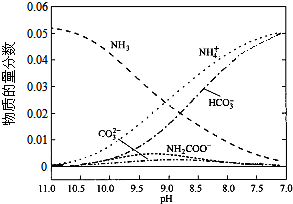

| A. | 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COOˉ)>c(CO32-) | |
| B. | 随着CO2的通入,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| C. | 不同pH的溶液中存在关系:c(NH4+)+c(H+)═2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) | |
| D. | 在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成 |
 ,与N3-互为等电子体的分子为N2O(写一种);
,与N3-互为等电子体的分子为N2O(写一种);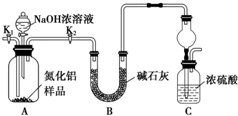
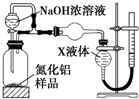
 d.NH4Cl溶液
d.NH4Cl溶液