题目内容
20.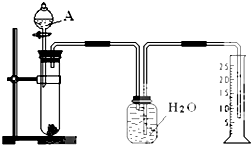 某同学设计了一个简单的实验(如图所示),以测定镁铝合金中铝的质量分数.可供选用的试剂有:浓H2SO4、浓硝酸、6mol•L-1NaOH溶液.请填写下列空白:
某同学设计了一个简单的实验(如图所示),以测定镁铝合金中铝的质量分数.可供选用的试剂有:浓H2SO4、浓硝酸、6mol•L-1NaOH溶液.请填写下列空白:(1)有关实验操作:a、往试管中放入适量的铝合金样品;b、从分液漏斗往试管中加入过量的A溶液;c、检查装置的气密性;d、测定收集到的水的体积.
正确的操作顺序为cabd.
(2)A溶液可选用6mol•L-1NaOH溶液.
(3)若实验中测得样品的质量为W g,氢气的体积为a L(标准状况),则样品中Al的质量分数为$\frac{9a}{11.2W}$×100%.
分析 用排水法收集气体,实验是通过测定生成氢气的体积,根据计算确定合金中Al的质量分数,
(1)收集气体的体积,加入药品前先检验装置的气密性,然后加热金属合金,再加入氢氧化钠溶液,测定收集到的水的体积确定生成氢气的体积;
(2)用排水法收集气体,实验是通过测定生成氢气的体积;
(3)根据生成氢气的体积计算合金中Al的质量,进而计算合金中Al的质量分数.
解答 解:用排水法收集气体,实验是通过测定生成氢气的体积,根据计算确定合金中Al的质量分数,
(1)收集气体的体积,加入药品前先检验装置的气密性,然后加热金属合金,再加入氢氧化钠溶液,测定收集到的水的体积确定生成氢气的体积,故正确的操作顺序为cabd,
故答案为:cabd;
(2)用排水法收集气体,实验是通过测定生成氢气的体积,故A中试剂为6mol•L-1NaOH溶液,
故答案为:6mol•L-1NaOH溶液;
(3)实验中测得样品的质量为Wg,氢气的体积为aL (标准状况),则:
2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
54g 3×22.4L
m(Al) aL
所以m(Al)=54g×$\frac{aL}{3×22.4L}$=$\frac{18a}{22.4}$g,
故合金中Al的质量分数=$\frac{\frac{18a}{22.4}g}{wg}$×100%=$\frac{18a}{22.4w}$×100%=$\frac{9a}{11.2W}$×100%,
故答案为:$\frac{9a}{11.2W}$×100%.
点评 本题考查物质组成含量的测定、元素化合物的性质、对实验原理的理解等,题目难度中等,是对学生基础上的综合运用,较好的考查学生的能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| B. | 10 mol•L-1的浓氨水:Al3+、NH4+、NO3-、I- | |
| C. | 与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、Na+、AlO2-、CO32- |
| A. | 酸雨 | B. | 干旱 | C. | 臭氧层空洞 | D. | 温室效应 |
| A. | NaCl | B. | NaCl、NaBr、NaI | C. | NaBr、NaI | D. | NaI |
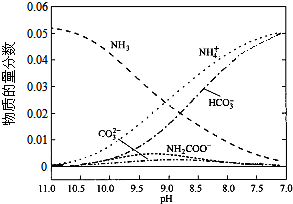
| A. | 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COOˉ)>c(CO32-) | |
| B. | 随着CO2的通入,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| C. | 不同pH的溶液中存在关系:c(NH4+)+c(H+)═2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) | |
| D. | 在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成 |
| A. | 将NaOH放在天平左边托盘中的纸片上 | |
| B. | 将NaOH放入烧杯中(烧杯事先已称重),并放在天平左边托盘上 | |
| C. | 用镊子取出标定为10.1 g的砝码放在天平右边的托盘上 | |
| D. | 用镊子取出标定为10 g的砝码放在天平左边的托盘上,并将游码向右移到0.1 g位置上 |
 A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.已知:
A、B、D、E、F五种元素的原子序数依次增大,除F为过渡元素外,其余四种均是短周期元素.已知: 原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E、F和C位于同一主族,F处于第一个长周期.
原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E、F和C位于同一主族,F处于第一个长周期.