题目内容
4. 实验室用如图方法测定某水样中O2的含量.
实验室用如图方法测定某水样中O2的含量.(1)实验原理
用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为2Mn2++O2+4OH-=2MnO(OH)2.再用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为:MnO(OH)2+2I-+4H+═Mn2++I2+3H2O然后用Na2S2O3 标准溶液滴定生成的I2,反应方程式为:I2+2Na2S2O3═2NaI+Na2S4O6.(2)实验步骤
①打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是赶走装置内空气,避免空气中的O2的干扰;
②用注射器抽取某水样20.00mL从A 处注入锥形瓶;
③再分别从A 处注入含m mol NaOH溶液及过量的MnSO4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A 处注人足量NaI溶液及含n mol H2SO4的硫酸溶液;
⑥重复④的操作.
⑦取下锥形瓶,向其中加入2~3滴淀粉溶液作指示剂;
⑧用0.005mol•L-1Na2S2O3 滴定至终点.
(3)数据分析
①若滴定过程中消耗的Na2S2O3 标准溶液体积为3.90mL,则此水样中氧(O2)的含量为7.8mg•L-1(单位:mg•L-1).
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将偏大(填“偏大”、“偏小”或“不变”).
分析 (1)根据题中反应物和生成物,利用化合价升降相等配平;
(2)①测定的是水样中氧气含量,必须将装置中的空气赶走,避免干扰测定结果;
⑦根据反应中有碘单质参与,利用碘遇到淀粉显示蓝色的特性,使用淀粉做指示剂;
(3)①根据反应原理找出反应的关系式,计算出试样中的氧含量;
②滴定管没有润洗,导致标准液浓度减小,消耗的标准液体积变大,氧气含量偏大.
解答 解:(1)溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,锰元素化合价升高2价,氧气化合价降低了4价,根据化合价升高降低相等配平反应的离子方程式为:2Mn2++O2+4OH-=2MnO(OH)2,
故答案为:2Mn2++O2+4OH-=2MnO(OH)2;
(2)①由于测定的是水样中氧气含量,必须将装置中的空气赶走,避免干扰测定结果,
故答案为:赶走装置内空气,避免空气中的O2的干扰;
⑦由于反应中有碘单质参与,利用碘遇到淀粉显示蓝色的特性,可以选用淀粉做指示剂,
故答案为:淀粉溶液;
(3)①发生的反应有:2Mn2++O2+4OH-=2MnO(OH)2、MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、I2+2Na2S2O3=2NaI+Na2S4O6,
氧气反应的关系式为:O2~2MnO(OH)2~2I2~4Na2S2O3,
1000mL水样中含有的氧气的物质的量是:n(O2)=$\frac{1}{4}$n(Na2S2O3)×$\frac{1000}{20}$=0.25×0.005mol•L-1×0.0036L×50=2.4375×10-4mol,
氧气的质量为:2.4375×10-4mol×32g/mol=7.8mg,
此水样中氧(O2)的含量为7.8mg•L-1,
故答案为:7.8mg•L-1;
②若未用Na2S2O3 标准溶液润洗滴定管,会导致标准液的浓度减小,消耗的标准液的体积增大,测定结果偏大,
故答案为:偏大.
点评 本题考查了水样中氧气含量的测定,涉及的内容较多,本题难度中等,需要分析实验原理并联系滴定知识合理完成,充分考查了学生的分析、理解能力.

 表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:
表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用元素符号或化学用语回答下列问题:| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
A.Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑
B.SiO2+2C$\frac{\underline{\;高温\;}}{\;}$ Si+2CO↑
C.Na2SiO3+CO2+2H2O═H2SiO3↓+Na2CO3
D.CH4比SiH4稳定
(2)①、④、⑤三种元素组成化合物所含化学键类型有离子键、共价键.
(3)④、⑤、⑥所形成的简单离子半径由大到小的顺序:O2->Na+>Al3+.(用元素符号表示)
(4)①、②、⑧三种元素按原子个数之比为11:5:1组成的有机化合物中含有两个-CH3的同分异构体有4种.
(5)某同学设计实验证明②、③、⑦的非金属性强弱关系.
①溶液a和b分别为硝酸,饱和NaHCO3溶液.
②溶液c中的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-或SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-.
| A. | NaCl | B. | NaCl、NaBr、NaI | C. | NaBr、NaI | D. | NaI |
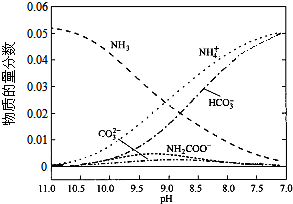
| A. | 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COOˉ)>c(CO32-) | |
| B. | 随着CO2的通入,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| C. | 不同pH的溶液中存在关系:c(NH4+)+c(H+)═2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) | |
| D. | 在溶液中pH不断降低的过程中,有含NH2COOˉ的中间产物生成 |

该黑色物质可能为炭与另一种氧化物组成的混合物.
根据题意和图示回答下面问题:
(1)装置图2中A的名称坩埚.
(2)此氧化物可能是FeO或Fe3O4(写化学式).
(3)对黑色固体物质的组成作如图3所示探究
①实验I加入盐酸溶液的目的是检验黑色固体物质中是否有碳,同时溶解氧化物.
②仅通过实验Ⅱ,用最简步骤能快速确定黑色氧化物的组成,请完善该设计.(限选试剂:稀盐酸、KSCN溶液、10%H2O2溶液)
| 实验操作 | 预期现象与结论 | 相关离子方程式 |
| 取少量实验Ⅰ中的澄清溶液,加入试剂适量的KSCN溶液 | 如果溶液显红色,则黑色物质为Fe3O4,反之则为FeO | Fe3++3SCN-═Fe(SCN)3 |
| A. | Na2SO4溶液 | B. | FeCl3溶液 | C. | Cu(NO3)2溶液 | D. | 稀硫酸 |
 原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E、F和C位于同一主族,F处于第一个长周期.
原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E、F和C位于同一主族,F处于第一个长周期.
 ,
, .
. .
.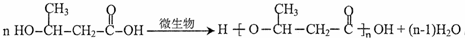 .
. (一种类似有机玻璃的塑料).
(一种类似有机玻璃的塑料).