题目内容
19.表是元素周期表的一部分,请回答有关问题:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)用电子式表示④元素与⑦元素形成的化合物形成过程
 .
.(3)③⑥⑦三种元素原子半径由小到大的顺序是F<Cl<S(用元素符号表示).
(4)③元素与⑩元素两者核电荷数之差是26.
(5)表中用于半导体材料的元素在元素周期表中的位置为第3周期ⅣA.
分析 由元素在周期表的位置可知,①~⑩分别为C、N、F、Mg、Al、S、Cl、Ar、K、Br,
(1)能形成两性氧化物的元素为Al,⑨最高价氧化物的水化物为KOH;
(2)④元素与⑦元素形成的化合物为氯化镁;
(3)电子层越多,半径越大,同周期原子序数大的半径小;
(4)③元素与⑩元素两者核电荷数分别为9、35;
(5)用于半导体材料的元素为Si.
解答 解:由元素在周期表的位置可知,①~⑩分别为C、N、F、Mg、Al、S、Cl、Ar、K、Br,
(1)能形成两性氧化物的元素为Al,⑨最高价氧化物的水化物为KOH,离子反应为2Al+2OH-+2H2O═2AlO2-+3H2↑,故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(2)④元素与⑦元素形成的化合物为氯化镁,用电子式表示形成过程为 ,
,
故答案为: ;
;
(3)电子层越多,半径越大,同周期原子序数大的半径小,原子半径为F<Cl<S,故答案为:F<Cl<S;
(4)③元素与⑩元素两者核电荷数分别为9、35,两者核电荷数之差是26,故答案为:26;
(5)用于半导体材料的元素为Si,位于第3周期ⅣA,故答案为:第3周期ⅣA.
点评 本题考查位置、结构与性质的关系及应用,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
9.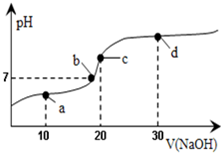 20℃时向20mL0.1mol/L醋酸溶液中不断滴入0.1mol/LNaOH(aq),溶液pH变化如图所示.此过程里溶液中离子浓度的关系错误的是( )
20℃时向20mL0.1mol/L醋酸溶液中不断滴入0.1mol/LNaOH(aq),溶液pH变化如图所示.此过程里溶液中离子浓度的关系错误的是( )
 20℃时向20mL0.1mol/L醋酸溶液中不断滴入0.1mol/LNaOH(aq),溶液pH变化如图所示.此过程里溶液中离子浓度的关系错误的是( )
20℃时向20mL0.1mol/L醋酸溶液中不断滴入0.1mol/LNaOH(aq),溶液pH变化如图所示.此过程里溶液中离子浓度的关系错误的是( )| A. | a点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | B. | b点:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) | ||
| C. | c点:c(H+)=c(CH3COOH)+c(OH-) | D. | d点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
10.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA | |
| B. | 0.5 mol O3与11.2 L O2所含的分子数一定相等 | |
| C. | 常温常压下,23 g NO2含有NA个氧原子 | |
| D. | 常温常压下,22.4 L CCl4含有NA个CCl4分子 |
7.二元酸H2A在水中发生电离:H2A═H++HA-和HA-?H++A2-,则下列几种物质的水溶液中关系式不正确的是( )
| A. | NaHA:c(Na+)>c(HA-)>c(OH-)>c(H+) | B. | NaHA:c(Na+)=c(A2-)+c(HA-) | ||
| C. | Na2A:c(Na+)>c(A2-)>c(OH-)>c(H+) | D. | H2A:c(H+)=c(HA-)+2c(A2-)+c(OH-) |
14.下列物质中不能用金属单质和非金属单质直接化合制得的是( )
| A. | CuO | B. | FeC13 | C. | CuS | D. | FeS |
11.下列各组化合物中,不论二者以何种比例混合,只要总质量一定,则完全燃烧时生成CO2的质量不变的是( )
①CH4、C2H6 ②C3H6、C3H8 ③C2H4、C3H8O ④C2H4、C3H6.
①CH4、C2H6 ②C3H6、C3H8 ③C2H4、C3H8O ④C2H4、C3H6.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ④ |
8.下列是某同学对相应反应的离子方程式所作的评价,其中对应评价合理的是( )
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | 把MgSO4溶液滴入Ba(OH)2溶液 | Mg2++2OH-═Mg(OH)2↓ | 正确 |
| B | 氧化铜与稀盐酸反应 | CuO+2H+ $\frac{\underline{\;\;△\;\;}}{\;}$Cu2++H2O | 正确 |
| C | 向FeCl2溶液中通入氯气 | Fe2++Cl2═Fe3++2Cl- | 正确 |
| D | AlCl3溶液中加足量氨水 | Al3++3OH-═Al(OH)3↓ | 正确 |
| A. | A | B. | B | C. | C | D. | D |