题目内容
11.下列各组化合物中,不论二者以何种比例混合,只要总质量一定,则完全燃烧时生成CO2的质量不变的是( )①CH4、C2H6 ②C3H6、C3H8 ③C2H4、C3H8O ④C2H4、C3H6.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ④ |
分析 根据无论以何种比例混合,只要混合物的总质量一定,完全燃烧生成CO2的质量也一定,则说明混合物各组分中含碳量相等,或混合物中最简式相同,以此来解答.
解答 解:①CH4、C2H6的最简式不同,含碳量不同,故不选;
②C3H6、C3H8的最简式不同,含碳量不同,故不选;
③C2H4、C3H8O中含碳量分别为$\frac{24}{28}$×100%=85.7%、$\frac{36}{60}$×100%=60%,含碳量不同,故不选;
④C2H4、C3H6的最简式均为CH2,含碳量相同,只要总质量一定,则完全燃烧时生成CO2的质量不变,故选;
故选D.
点评 本题考查有机物燃烧计算,为高频考点,把握有机物的含碳量计算、最简式为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
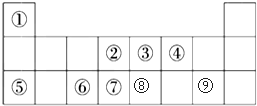
19.表是元素周期表的一部分,请回答有关问题:
(1)表中能形成两性氧化物的元素所形成的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.
(2)用电子式表示④元素与⑦元素形成的化合物形成过程 .
.
(3)③⑥⑦三种元素原子半径由小到大的顺序是F<Cl<S(用元素符号表示).
(4)③元素与⑩元素两者核电荷数之差是26.
(5)表中用于半导体材料的元素在元素周期表中的位置为第3周期ⅣA.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)用电子式表示④元素与⑦元素形成的化合物形成过程
 .
.(3)③⑥⑦三种元素原子半径由小到大的顺序是F<Cl<S(用元素符号表示).
(4)③元素与⑩元素两者核电荷数之差是26.
(5)表中用于半导体材料的元素在元素周期表中的位置为第3周期ⅣA.
20. 下表给出五种元素的相关信息,根据以下信息填空:
下表给出五种元素的相关信息,根据以下信息填空:
(1)D的元素符号为Ca.14gA的单质分子中π键的个数为6.02×1023 .
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是水分子之间形成氢键.
(3)A、B、C 3种元素的电负性由大到小的顺序为F>N>O(用元素符号表示).
(4)E2+的价层电子排布图为 .
.
(5)A的最简单氢化物分子的空间构型为三角锥形,其中A原子的杂化类型是sp3杂化.
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g•cm-3,阿伏加德罗常数为NA,求晶胞边长a=$\root{3}{\frac{4×78}{ρ{N}_{A}}}$cm.(用ρ、NA的计算式表示)
 下表给出五种元素的相关信息,根据以下信息填空:
下表给出五种元素的相关信息,根据以下信息填空:| 元素 | 相关信息 |
| A | 基态原子2p能级有3个单电子 |
| B | 基态原子p轨道上成对电子数等于未成对电子数 |
| C | 氢化物常用于刻蚀玻璃 |
| D | 基态原子核外电子分处6个不同能级,且每个能级均已排满 |
| E | 原子序数等于C与D的原子序数之和 |
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是水分子之间形成氢键.
(3)A、B、C 3种元素的电负性由大到小的顺序为F>N>O(用元素符号表示).
(4)E2+的价层电子排布图为
 .
.(5)A的最简单氢化物分子的空间构型为三角锥形,其中A原子的杂化类型是sp3杂化.
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g•cm-3,阿伏加德罗常数为NA,求晶胞边长a=$\root{3}{\frac{4×78}{ρ{N}_{A}}}$cm.(用ρ、NA的计算式表示)
1.酸雨中存在电离平衡:H2S03?H++HSO${\;}_{3}^{-}$和HSO${\;}_{3}^{-}$?H++S032-,下列说法正确的是( )
| A. | 若向H2SO3,溶液中加入氯化钙溶液,平衡向右移动,会产生亚硫酸钙沉淀. | |
| B. | 若向H2S03溶液巾加人氢氧化钠溶液,平衡向右移动,pH变大 | |
| C. | 适当升溫(假如亚硫酸不分解不挥发),平衡向左移动,电离平衡常数减小 | |
| D. | 25℃时,笫一步电离常数K,小于第二步电离常数K2 |
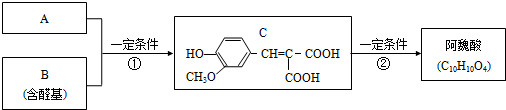
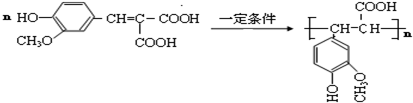 .
.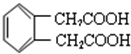 .
.
 .
.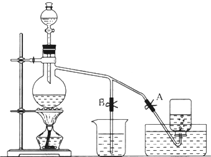 如图表示在没有通风橱的条件下制备氯气时设计的装置,图中A、B是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.)
如图表示在没有通风橱的条件下制备氯气时设计的装置,图中A、B是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.)