题目内容
14.下列物质中不能用金属单质和非金属单质直接化合制得的是( )| A. | CuO | B. | FeC13 | C. | CuS | D. | FeS |
分析 氯气具有强氧化性,与金属单质反应时得到高价态金属氯化物,硫是弱氧化剂,将变价金属氧化成低价态的金属,以此来解答.
解答 解:A、铜与氧气反应生成氧化铜,故A不选;
B、铁与氯气在点燃或加热时直接生成氯化铁,而不生成氯化亚铁,故B不选;
C、铜是变价金属,硫氧化性弱反应生成低价硫化物,2Cu+S=Cu2S,不能用硫和金属在一定条件下直接化合得到CuS,故C符合;
D、铁是变价金属,硫氧化性弱反应生成低价硫化物,Fe+S=FeS,故D不选;
故选C.
点评 本题考查了硫单质性质和金属性质的分析判断,注意变价金属元素和硫反应的产物分析判断,掌握基础是关键,题目较简单.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
5.现有pH=5的CH3COOH溶液加水稀释1000倍,稀释后溶液中的( )
| A. | pH=8 | B. | pH=7 | C. | pH=6 | D. | pH无限接近7 |
9.下列方法不能用于实验室制取氨气的是( )
| A. | 固体氯化铵和消石灰共热 | B. | 加热浓氨水 | ||
| C. | 浓氨水滴加到碱石灰中 | D. | 加热固体氯化铵 |
19.表是元素周期表的一部分,请回答有关问题:
(1)表中能形成两性氧化物的元素所形成的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.
(2)用电子式表示④元素与⑦元素形成的化合物形成过程 .
.
(3)③⑥⑦三种元素原子半径由小到大的顺序是F<Cl<S(用元素符号表示).
(4)③元素与⑩元素两者核电荷数之差是26.
(5)表中用于半导体材料的元素在元素周期表中的位置为第3周期ⅣA.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)用电子式表示④元素与⑦元素形成的化合物形成过程
 .
.(3)③⑥⑦三种元素原子半径由小到大的顺序是F<Cl<S(用元素符号表示).
(4)③元素与⑩元素两者核电荷数之差是26.
(5)表中用于半导体材料的元素在元素周期表中的位置为第3周期ⅣA.
4.在1L某混合溶液中,c(HNO3)=0.4mol/L,c(H2SO4)=0.1mol/L,向其中加入 19.2g铜粉,微热,充分反应后溶液中c(Cu2+)为( )
| A. | 0.15mol/L | B. | 0.3mol/L | C. | 0.225mol/L | D. | 无法计算 |
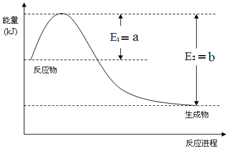 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义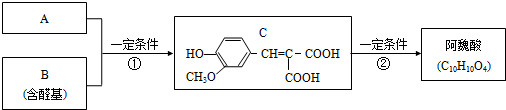
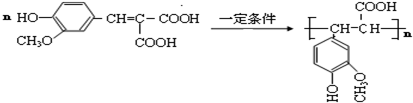 .
. .
.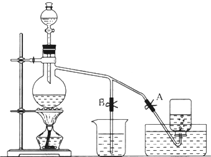 如图表示在没有通风橱的条件下制备氯气时设计的装置,图中A、B是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.)
如图表示在没有通风橱的条件下制备氯气时设计的装置,图中A、B是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.)