题目内容
9.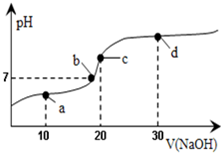 20℃时向20mL0.1mol/L醋酸溶液中不断滴入0.1mol/LNaOH(aq),溶液pH变化如图所示.此过程里溶液中离子浓度的关系错误的是( )
20℃时向20mL0.1mol/L醋酸溶液中不断滴入0.1mol/LNaOH(aq),溶液pH变化如图所示.此过程里溶液中离子浓度的关系错误的是( )| A. | a点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | B. | b点:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) | ||
| C. | c点:c(H+)=c(CH3COOH)+c(OH-) | D. | d点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
分析 A.a点溶液为CH3COOH和CH3COONa的混合物,溶液呈酸性;
B.根据电荷守恒及溶液的酸碱性进行判断;
C.c点时,溶液呈碱性;
D.d点为NaOH和CH3COONa的混合物,溶液呈碱性.
解答 解:A.a点时醋酸过量,溶液为CH3COOH和CH3COONa的混合物,溶液呈酸性,所以c(H+)>c(OH-),溶液呈电中性,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)<c(CH3COO-),则c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故A正确;
B.根据溶液电荷守恒可知溶液中应存在c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液呈中性,应有c(H+)=c(OH-),则c(Na+)=c(CH3COO-),所以溶液中离子浓度关系:c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故B正确;
C.c点时,溶液呈碱性,应有c(H+)<c(OH-),故C错误;
D.d点为NaOH和CH3COONa的混合物,且2c(NaOH)=c(CH3COONa),溶液呈碱性,醋酸根离子水解但水解程度较小,所以溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D正确.
故选C.
点评 本题考查酸碱混合的判断和离子浓度大小比较,答题时注意a、b、c、d点溶液的组成,把握弱电解质的电离和盐类水解的特点,题目难度中等.

练习册系列答案
相关题目
20.在相同温度时,100mL 0.01mol•L-1的醋酸溶液与10mL 0.1mol•L-1的醋酸溶液相比较,下列数值中,前者大于后者的是( )
| A. | 电离程度 | B. | 醋酸的电离常数 | ||
| C. | 中和时所需NaOH的物质的量 | D. | CH3COOH的物质的量 |
17.用物质的量浓度相同的盐酸分别中和pH值相等、体积相同的氨水、氢氧化钠和氢氧化钡溶液,所消耗的盐酸体积依次用V1、V2、V3表示,它们之间的关系正确的是( )
| A. | V1>V2=V3 | B. | V1>V2>V3 | C. | V1=V2=V3 | D. | V1=V2<V3 |
14.下列离子方程式书写正确的是( )
| A. | Na2SO3溶液中加入稀硝酸:SO32-+2H+═SO2↑+H2O | |
| B. | NH4HSO3溶液与少量的NaOH溶液混合加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| C. | FeBr2溶液中通入足量的Cl2:4Fe2++4Br-+3Cl2═4Fe3++2Br2+6Cl- | |
| D. | 向碳酸氢钙溶液加入少量氢氧化钾溶液:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- |
18.下列关于有机物的说法中,正确的是( )
| A. | 乙醇和乙酸分子中均含有一OH,均可与NaOH反应 | |
| B. | 甲烷和乙烯均能使酸性的高锰酸钾溶液褪色 | |
| C. | 苯分子是一种单双键交替排列的特殊结构,所以既可发生取代又能加成反应 | |
| D. | 煤和石油均为混合物 |
19.表是元素周期表的一部分,请回答有关问题:
(1)表中能形成两性氧化物的元素所形成的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.
(2)用电子式表示④元素与⑦元素形成的化合物形成过程 .
.
(3)③⑥⑦三种元素原子半径由小到大的顺序是F<Cl<S(用元素符号表示).
(4)③元素与⑩元素两者核电荷数之差是26.
(5)表中用于半导体材料的元素在元素周期表中的位置为第3周期ⅣA.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)用电子式表示④元素与⑦元素形成的化合物形成过程
 .
.(3)③⑥⑦三种元素原子半径由小到大的顺序是F<Cl<S(用元素符号表示).
(4)③元素与⑩元素两者核电荷数之差是26.
(5)表中用于半导体材料的元素在元素周期表中的位置为第3周期ⅣA.
 运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义