题目内容
8.下列是某同学对相应反应的离子方程式所作的评价,其中对应评价合理的是( )| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | 把MgSO4溶液滴入Ba(OH)2溶液 | Mg2++2OH-═Mg(OH)2↓ | 正确 |
| B | 氧化铜与稀盐酸反应 | CuO+2H+ $\frac{\underline{\;\;△\;\;}}{\;}$Cu2++H2O | 正确 |
| C | 向FeCl2溶液中通入氯气 | Fe2++Cl2═Fe3++2Cl- | 正确 |
| D | AlCl3溶液中加足量氨水 | Al3++3OH-═Al(OH)3↓ | 正确 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.反应生成硫酸钡和氢氧化镁;
B.反应生成氯化铜和水;
C.反应生成氯化铁,电子、电荷不守恒;
D.反应生成氢氧化铝和氯化铵,一水合氨在离子反应中保留化学式.
解答 解:A.把MgSO4溶液滴入Ba(OH)2溶液的离子反应为Ba2++SO42-+Mg2++2OH-═Mg(OH)2↓+BaSO4↓,故A错误;
B.氧化铜与稀盐酸反应的离子反应为CuO+2H+$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++H2O,故B正确;
C.向FeCl2溶液中通入氯气的离子反应为2Fe2++Cl2═2Fe3++2Cl-,故C错误;
D.AlCl3溶液中加足量氨水的离子反应为Al3++3NH3.H2O═Al(OH)3↓+3NH4+,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
相关题目
18.下列关于有机物的说法中,正确的是( )
| A. | 乙醇和乙酸分子中均含有一OH,均可与NaOH反应 | |
| B. | 甲烷和乙烯均能使酸性的高锰酸钾溶液褪色 | |
| C. | 苯分子是一种单双键交替排列的特殊结构,所以既可发生取代又能加成反应 | |
| D. | 煤和石油均为混合物 |
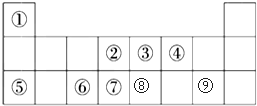
19.表是元素周期表的一部分,请回答有关问题:
(1)表中能形成两性氧化物的元素所形成的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O═2AlO2-+3H2↑.
(2)用电子式表示④元素与⑦元素形成的化合物形成过程 .
.
(3)③⑥⑦三种元素原子半径由小到大的顺序是F<Cl<S(用元素符号表示).
(4)③元素与⑩元素两者核电荷数之差是26.
(5)表中用于半导体材料的元素在元素周期表中的位置为第3周期ⅣA.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)用电子式表示④元素与⑦元素形成的化合物形成过程
 .
.(3)③⑥⑦三种元素原子半径由小到大的顺序是F<Cl<S(用元素符号表示).
(4)③元素与⑩元素两者核电荷数之差是26.
(5)表中用于半导体材料的元素在元素周期表中的位置为第3周期ⅣA.
13.下列关于糖类、蛋白质、油脂和维生素的说法中,正确的是( )
| A. | 它们的组成都含有C、H、O、N等元素 | |
| B. | 油脂都是高级脂肪酸的甘油酯,是一种高热量营养素 | |
| C. | 人体需要的二十多种氨基酸,都可以通过人体自身合成 | |
| D. | 在一定条件下,它们都能发生水解反应 |
20. 下表给出五种元素的相关信息,根据以下信息填空:
下表给出五种元素的相关信息,根据以下信息填空:
(1)D的元素符号为Ca.14gA的单质分子中π键的个数为6.02×1023 .
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是水分子之间形成氢键.
(3)A、B、C 3种元素的电负性由大到小的顺序为F>N>O(用元素符号表示).
(4)E2+的价层电子排布图为 .
.
(5)A的最简单氢化物分子的空间构型为三角锥形,其中A原子的杂化类型是sp3杂化.
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g•cm-3,阿伏加德罗常数为NA,求晶胞边长a=$\root{3}{\frac{4×78}{ρ{N}_{A}}}$cm.(用ρ、NA的计算式表示)
 下表给出五种元素的相关信息,根据以下信息填空:
下表给出五种元素的相关信息,根据以下信息填空:| 元素 | 相关信息 |
| A | 基态原子2p能级有3个单电子 |
| B | 基态原子p轨道上成对电子数等于未成对电子数 |
| C | 氢化物常用于刻蚀玻璃 |
| D | 基态原子核外电子分处6个不同能级,且每个能级均已排满 |
| E | 原子序数等于C与D的原子序数之和 |
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是水分子之间形成氢键.
(3)A、B、C 3种元素的电负性由大到小的顺序为F>N>O(用元素符号表示).
(4)E2+的价层电子排布图为
 .
.(5)A的最简单氢化物分子的空间构型为三角锥形,其中A原子的杂化类型是sp3杂化.
(6)C和D形成的化合物的晶胞结构如图所示,已知晶体的密度为ρ g•cm-3,阿伏加德罗常数为NA,求晶胞边长a=$\root{3}{\frac{4×78}{ρ{N}_{A}}}$cm.(用ρ、NA的计算式表示)
17.下列热化学方程式中的反应热(括号内)表示燃烧热的是( )
| A. | NH3(g)+$\frac{5}{4}$O2(g)═NO(g)+$\frac{6}{4}$H2O(g);△H=-akJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-bkJ•mol-1 | |
| C. | 2CO(g)+O2(g)═2CO2(g);△H=-ckJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)═CH3CHO(l)+H2O(l);△H=-dkJ•mol-1 |
 .
.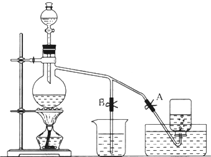 如图表示在没有通风橱的条件下制备氯气时设计的装置,图中A、B是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.)
如图表示在没有通风橱的条件下制备氯气时设计的装置,图中A、B是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.)