题目内容
6.下列说法不正确的是( )| A. | 0.2mol/L的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-) | |
| B. | 常温下,将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,盐酸需加的水多 | |
| C. | 常温下,向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+)=c(Cl-) | |
| D. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
分析 A、HCO3-的水解程度大于电离程度;
B、醋酸溶液中存在电离平衡;
C、常温下,向氨水中逐滴滴入盐酸至溶液的pH=7,c(H+)=c(OH-),根据电荷守恒来分析;
D、NaHSO4溶液中,c(Na+)=c(SO42-),根据电荷守恒来分析.
解答 解:A、HCO3-既能水解又能电离,故c(Na+)>c(HCO3-),而HCO3-的水解程度大于电离程度,故溶液显碱性,即c(OH-)>c(H+),而溶液中的氢离子既来自于HCO3-的电离,还来自于水的电离,故有c(H+)>c(CO32-),则离子浓度为c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),故A正确;
B、醋酸溶液中存在电离平衡,当将等体积pH=4的盐酸和醋酸稀释时,醋酸的电离被促进,能电离出更多的氢离子,故若同样稀释至pH=5,则醋酸加水更多,故B错误;
C、常温下,向氨水中逐滴滴入盐酸至溶液的pH=7,则c(H+)=c(OH-),根据电荷守恒可知c(NH4+)+c(H+)=c(OH-)+(Cl-),故有c(NH4+)=c(Cl-),故C正确;
D、NaHSO4溶液中,有c(Na+)=c(SO42-),而根据电荷守恒可知:c(H+)+c(Na+)=2c(SO42-)+c(OH-),故有:c(H+)=c(SO42-)+c(OH-),故D正确.
故选B.
点评 本题考查了盐类的水解平衡以及三个守恒的应用和弱电解质的电离平衡的移动,难度不大,应注意弱电解质和强电解质溶液加水稀释时的区别.

练习册系列答案
相关题目
13.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L HF中含有的电子数为10NA | |
| B. | 在一定条件下,1molSO2和0.5molO2在密闭容器中充分反应,转移电子数目为2NA | |
| C. | 常温常压下,32gN2H4中含有的共价键数目为5NA | |
| D. | 某饱和FeCl3溶液中,若Fe3+的数目为NA,则Cl-的数目为3NA |
1.将1.52g铜镁合金完全溶解于50mL密度为1.40g•mL-1、质量分数为63%的浓硝酸得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol•L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )
| A. | 该合金中铜与镁的物质的量之比是2:1 | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol•L-1 | |
| C. | 得到2.54g沉淀时,加入NaOH溶液的体积是600L | |
| D. | NO2和N2O4的混合气体中,NO2的体积分数是80% |
18.下列有机物同分异构体数目判断错误的是( )
| 选项 | 有机物 | 同分异构体数目 |
| A | 分子式为C6H14且含有三个甲基 | 2 |
| B | 分子式为C5H10,不能使溴的四氯化碳溶液褪色 | 5 |
| C | 分子式为C4H10O,不能与Na反应生成氢气 | 4 |
| D | 分子式为C4H8O2能与NaHCO3反应产生气体 | 2 |
| A. | A | B. | B | C. | C | D. | D |
16.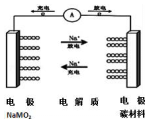 C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍.该电池的电池反应式为:NaMO2+nC?Na(1-x)MO2+NaxCn,下列有关该电池的说法正确的是( )
C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍.该电池的电池反应式为:NaMO2+nC?Na(1-x)MO2+NaxCn,下列有关该电池的说法正确的是( )
 C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍.该电池的电池反应式为:NaMO2+nC?Na(1-x)MO2+NaxCn,下列有关该电池的说法正确的是( )
C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍.该电池的电池反应式为:NaMO2+nC?Na(1-x)MO2+NaxCn,下列有关该电池的说法正确的是( )| A. | 电池放电时,溶液中钠离子向负极移动 | |
| B. | 电池充电时的阳极反应式为:nC+x Na+-xe-═NaxCn | |
| C. | 消耗相同质量金属时,用锂作负极产生电子的物质的量比用钠时少 | |
| D. | 该电池负极的电极反应为:NaMO2-xe-═Na(1-x)MO2+xNa+ |
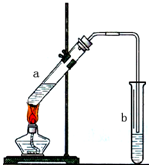 用如图示装置制取少量乙酸乙酯.已知乙酸乙酯的沸点低于乙醇.请填空:
用如图示装置制取少量乙酸乙酯.已知乙酸乙酯的沸点低于乙醇.请填空: