题目内容
17.现有以下物质:①食盐水 ②二氧化碳 ③盐酸 ④蔗糖 ⑤熔融的硫酸钾 ⑥氧气 ⑦液体醋酸 ⑧金属铜 ⑨碳酸氢钠固体 ⑩氢氧化钠固体.请回答下列问题(用序号填写)(1)能导电的是①③⑤⑧;
(2)属于电解质的是⑤⑦⑨⑩;
(3)属于非电解质的是②④.
分析 (1)物质导电的条件:存在自由电子或者自由移动的离子;
(2)在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、活泼金属氧化物和水;
(3)非电解质是在水溶液里和熔融状态下都不能导电的化合物,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等).
解答 解:①食盐水含有自由移动离子,导电,属于混合物,不是电解质,也不是非电解质;
②二氧化碳不含有自由电子和自由移动离子,不导电,水溶液里和熔融状态下都不能导电,属于非电解质;
③盐酸含有自由移动离子,导电,属于混合物,不是电解质,也不是非电解质;
④蔗糖不含有自由电子和自由移动离子,不导电,水溶液里和熔融状态下都不能导电,属于非电解质;
⑤熔融的硫酸钾含有自由移动的离子,能够导电,属于电解质;
⑥氧气不含有自由电子和自由移动离子,不导电,属于单质,不是电解质,也不是非电解质;
⑦液体醋酸,不含有自由电子和自由移动离子,不导电,水溶液里能够导电,属于电解质;
⑧熔融的硫酸钾含有自由移动的离子,能够导电,属于电解质; ⑧金属铜含有自由电子,导电,属于单质,不是电解质,也不是非电解质;
⑨碳酸氢钠固体不含有自由电子和自由移动离子,不导电,水溶液里和熔融状态下能导电,属于电解质;
⑩氢氧化钠固体不含有自由电子和自由移动离子,不导电,在水溶液里或熔融状态下能导电,是电解质;
(1)根据分析可知,以上物质能导电的是:①③⑤⑧,
故答案为:①③⑤⑧;
(2)以上物质属于电解质的是:⑤⑦⑨⑩,
故答案为:⑤⑦⑨⑩;
(3)以上物质属于非电解质的是:②④,
故答案为:②④.
点评 本题考查了电解质与非电解质的判断,题目难度不大,明确电解质、非电解质的概念为解答关键,注意掌握溶液导电性的条件,试题培养了学生的灵活应用能力.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案
相关题目
5.化学与生产、生活、社会密切相关,下列有关说法中正确的是( )
| A. | 煤炭经气化、液化和干馏等处理后,可转化为清洁能源 | |
| B. | “绿蚁新醅酒,红泥小火炉”,“新醅酒”即新酿的酒,在酿酒的过程中,葡萄糖发生了水解反应 | |
| C. | 地沟油和矿物油的主要化学成分相同 | |
| D. | 聚氯乙烯可以用作食品包装袋 |
5.硫是一种生命元素,组成某些蛋白质时离不开它.SO2是硫的一种重要氧化物,为探究SO2的性质,某化学兴趣小组的同学设计了如下系列实验:
(1)为验证SO2具有还原性.将SO2气体通入溴水中,溴水褪色.写出反应的化学方程式SO2+Br2+2H2OH2SO4+2HBr.
(2)已知与SO2Na2O2的反应为进一步探究Na2O2与SO2的反应,用如图所示装置进行实验.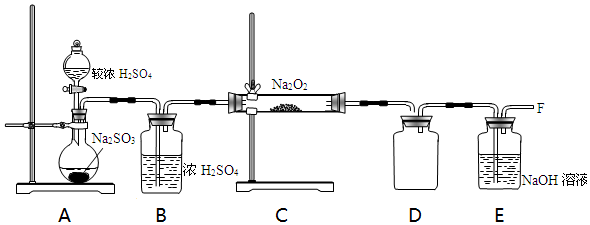
①写出A中反应的化学方程式H2SO4+Na2SO3 =Na2SO4+SO2↑+H2O.
②B装置的作用是干燥吸水.
③在F处检验到有O2生成,据此甲同学认为Na2O2与SO2发生了反应,反应的化学方程式为2Na2O2+2SO2=2Na2SO3+O2.
④乙同学认为Na2O2与SO2反应除生成Na2SO3和O2外,还有Na2SO4生成,为检验是否有Na2SO4生成,他们设计了如下实验方案.
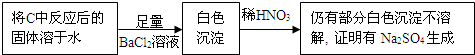
上述方案(“合理”或“不合理”)不合理,简要说明理由稀硝酸能将亚硫酸钡氧化为硫酸钡,如果反应后的固体中还残留Na2O2,它溶于水也能将亚硫酸根氧化成硫酸根.
⑤E装置中溶液呈碱性,为检验吸收液中其他阴离子,完成下列实验方案.
(1)为验证SO2具有还原性.将SO2气体通入溴水中,溴水褪色.写出反应的化学方程式SO2+Br2+2H2OH2SO4+2HBr.
(2)已知与SO2Na2O2的反应为进一步探究Na2O2与SO2的反应,用如图所示装置进行实验.

①写出A中反应的化学方程式H2SO4+Na2SO3 =Na2SO4+SO2↑+H2O.
②B装置的作用是干燥吸水.
③在F处检验到有O2生成,据此甲同学认为Na2O2与SO2发生了反应,反应的化学方程式为2Na2O2+2SO2=2Na2SO3+O2.
④乙同学认为Na2O2与SO2反应除生成Na2SO3和O2外,还有Na2SO4生成,为检验是否有Na2SO4生成,他们设计了如下实验方案.

上述方案(“合理”或“不合理”)不合理,简要说明理由稀硝酸能将亚硫酸钡氧化为硫酸钡,如果反应后的固体中还残留Na2O2,它溶于水也能将亚硫酸根氧化成硫酸根.
⑤E装置中溶液呈碱性,为检验吸收液中其他阴离子,完成下列实验方案.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量吸收液于试管中滴加BaCl2溶液至过量 | 白色浑浊 | 吸收液中存在SO32-和SO42- |
| 取步骤I中白色沉淀于试管中,加入过量的稀盐酸 | 固体部分溶解,产生气泡 |
2.若已知:
H2(g)+$\frac{1}{2}$O2(g)=H2O(g):△H=a kJ/mol
H2(g)+$\frac{1}{2}$O2(g)=H2O(l):△H=b kJ/mol
2H2O(g)=2H2(g)+O2(g):△H=c kJ/mol
关于它们的下列表述正确的是( )
H2(g)+$\frac{1}{2}$O2(g)=H2O(g):△H=a kJ/mol
H2(g)+$\frac{1}{2}$O2(g)=H2O(l):△H=b kJ/mol
2H2O(g)=2H2(g)+O2(g):△H=c kJ/mol
关于它们的下列表述正确的是( )
| A. | a+b+c=0 | B. | c=2a | C. | a>b | D. | c=a+b |
9.下列物质不属于离子化合物的是( )
| A. | KOH | B. | H2SO3 | C. | KCl | D. | NaNO3 |
6.下列说法不正确的是( )
| A. | 0.2mol/L的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-) | |
| B. | 常温下,将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,盐酸需加的水多 | |
| C. | 常温下,向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+)=c(Cl-) | |
| D. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
7.我国酒文化源远流长.下列古法酿酒工艺中,以发生化学反应为主的过程是( )
| A. |  酒曲捣碎 | B. |  酒曲发酵 酒曲发酵 | C. |  高温蒸馏 高温蒸馏 | D. |  泉水勾兑 |