��Ŀ����
11��������������֪ʶ����������⣮��1����ʵ��������ȡCl2�������ռ�Cl2��װ������ͼ1��ȷ����C������ĸ����Ư���������ᷢ����Ӧ��������Ũ�Ȳ�ͬʱ��Ư���������Ϸ�����Ӧ�����Ͳ�ͬ��Ư����ϡ���ᷢ�����ֽⷴӦ����ѧ����ʽΪCa��ClO��2+2HCl�TCaCl2+2HClO��Ư����Ũ���ᷢ��������ԭ��Ӧ����ѧ����ʽΪCa��ClO��2+4HCl��Ũ���TCaCl2+2Cl2��+2H2O��
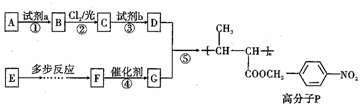
��2����ˮ�к��ж��ֳɷ֣�������кܶ����ʣ�������ˮ�ֱ�����ͼ2�������ʷ����ķ�Ӧ��գ�a��b��c��d�غϲ��ִ������ʼ䷴Ӧ������ˮ��������
����֤����ˮ����Ư���Ե���d���a����b����c����d������
��c�����е������Dz�����ɫ������
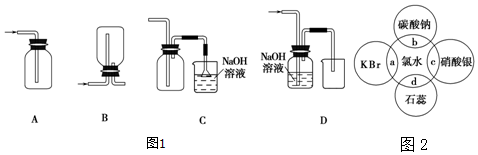
���� ��1�������DZȿ����صĿ�����ˮ���ж����壬���������������ʺ�װ�÷�������������ǿ�ڴ����ᣬƯ����ϡ���ᷴӦ�����Ȼ��ƺʹ�������ȸ����Ӿ���ǿ�������ԣ��ܹ�����Ũ���ᣬ���߷������з�Ӧ�������������ݵ�ʧ�����غ㡢ԭ�Ӹ����غ���д����ʽ��
��2������������ˮ�õ���ˮ��dz����ɫ������ˮ����������������H2O��Cl2��HClO��Cl-��H+��OH-����������ˮ����������ģ���
��ˮ������ȡ��������ɵ�����
��1��ǿ�����ԣ�Cl2��������ˮ����Ҫ�ɷ֣�ʵ���ҳ�����ˮ��������������ˮ�е���������KI��KBr��FeCl2��SO2��Na2SO3�����ʷ�Ӧ��
��2��Ư�ס������ԣ���ˮ�е�Cl2��HClO����ǿ�����ԣ�һ����Ӧ����Ư������ʱ��Ӧ����HClO��HClO��ǿ�����Խ���ɫ������������ɫ���ʣ������森
��3�����ԣ���ˮ�к���HCl��HClO���ʿɱ�NaOH�кͣ����ỹ����NaHCO3��CaCO3�ȷ�Ӧ��
��4�����ȶ��ԣ�HClO���ȶ������ֽ⣮ ��˾�����ˮ��dz����ɫ������ϡ���ᣨ��ɫ��ʧȥƯ���ԣ�
��5��������Ӧ������AgNO3��Һ�а�ɫ�������ɣ���ˮ����Cl-����
��� �⣺��1�������DZȿ����صĿ�����ˮ���ж����壻
A��������λ����ȷ����Ϊ�����ȿ�����������������������ֻ�н����ڣ������ڣ����ų����壬��A����
B����װ���������ռ��ȿ���������壬���ռ���������Ҫ�̽���������B����
C��װ�ó����̳������ռ��ȿ����ص�����������ʣ��������ж���Ҫ������������Һ���գ�Ϊ��ֹ�������õ�����ˮ���©��������Ҫ��C��ȷ��
D������ͨ��NaOH��Һ�ᷢ����Ӧ�������������������գ������ռ�����������D����
��ѡ��C��
��������ǿ�ڴ����ᣬƯ����ϡ���ᷴӦ�����Ȼ��ƺʹ����ᣬ����ʽ��Ca��ClO��2+2HCl�TCaCl2+2HClO��
���ȸ����Ӿ���ǿ�������ԣ��ܹ�����Ũ���ᣬ������������ᷢ��������ԭ��Ӧ�����������Ȼ��ƺ�ˮ������ʽ��Ca��ClO��2+4HCl��Ũ���TCaCl2+2Cl2��+2H2O��
�ʴ�Ϊ��C��Ca��ClO��2+2HCl�TCaCl2+2HClO��Ca��ClO��2+4HCl��Ũ���TCaCl2+2Cl2��+2H2O��
��2������ˮ�е�HClO��ǿ�����ԣ�һ����Ӧ����Ư��ʱ��HClO��ǿ�����Խ���ɫ������������ɫ���ʣ���������ˮ��ʹʯ����Һ�ȱ�죬����ɫ��
�ʴ�Ϊ��d��
����ˮ����Cl-������AgNO3��Һ�а�ɫ�������ɣ�����AgCl������
�ʴ�Ϊ���а�ɫ�������ɣ�
���� ���⿼����������Ʊ��ռ�����ѡ����ʽ����д�����ʵļ��飬��ȷ�������Ʊ�ԭ�������ʡ���Ϥ��ˮ�ijɷּ������ǽ���ؼ�����Ŀ�Ѷ��еȣ�

 ����һ����ﹲ�м��֣������������칹����������
����һ����ﹲ�м��֣������������칹����������| A�� | 3�� | B�� | 4�� | C�� | 5�� | D�� | 6�� |
H2��g��+$\frac{1}{2}$O2��g��=H2O��g������H=a kJ/mol
H2��g��+$\frac{1}{2}$O2��g��=H2O��l������H=b kJ/mol
2H2O��g��=2H2��g��+O2��g������H=c kJ/mol
�������ǵ����б�����ȷ���ǣ�������
| A�� | a+b+c=0 | B�� | c=2a | C�� | a��b | D�� | c=a+b |
| A�� | 0.2mol/L��NaHCO3��Һ�У�c��Na+����c��HCO3-����c��OH-����c��H+����c��CO32-�� | |
| B�� | �����£��������pH=4������ʹ���ϡ�ͳ�pH=5����Һ��������ӵ�ˮ�� | |
| C�� | �����£���ˮ����ε�����������Һ��pH=7������Һ�У�c��NH4+��=c��Cl-�� | |
| D�� | pH=1��NaHSO4��Һ��c��H+��=c��SO42-��+c��OH-�� |
| A�� | ��Һ����Fe2+��Cu2+ | B�� | ��Һ����Fe3+��Fe2+ | ||
| C�� | ʣ�µĹ�����Fe | D�� | ��Һ�в���Fe3+��Cu2+ |
| A�� | ��֬�������������������࣬������ͬϵ�� | |
| B�� | �������һ�ȴ�����5�� | |
| C�� | ͼ�� ��̪�����е������������ܹ�ƽ�� ��̪�����е������������ܹ�ƽ�� | |
| D�� | ij�л�����ȫȼ�����ɵ����ʵ�����CO2��H2O�����л���ķ���ʽһ��ΪCnH2n |
 ���Լ�a��Ũ�����Ũ���ᣮ
���Լ�a��Ũ�����Ũ���ᣮ +NaOH$��_{��}^{H_{2}O}$
+NaOH$��_{��}^{H_{2}O}$ +NaCl��
+NaCl��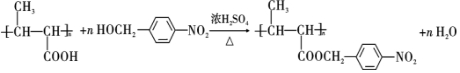 ��
��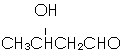 ����EΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�F��д���ϳ�·��
����EΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�F��д���ϳ�·��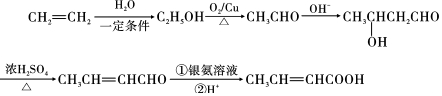 ���ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������
���ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������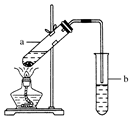 ʵ���ҳ�����ͼ��ʾװ����ȡ����������������ش��������⣺
ʵ���ҳ�����ͼ��ʾװ����ȡ����������������ش��������⣺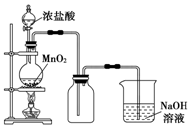 ʵ�����г���MnO2����Ũ����ķ�����ȡ������ʵ��װ����ͼ��ʾ��
ʵ�����г���MnO2����Ũ����ķ�����ȡ������ʵ��װ����ͼ��ʾ��