题目内容
14. 用如图示装置制取少量乙酸乙酯.已知乙酸乙酯的沸点低于乙醇.请填空:
用如图示装置制取少量乙酸乙酯.已知乙酸乙酯的沸点低于乙醇.请填空:(1)试管a中需加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序及操作是先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,最后再加入冰醋酸.
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是在试管a中加入几粒沸石(或碎瓷片).
(3)实验中试管a中的反应是:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;反应类型是酯化反应.
(4)试管b中加有饱和Na2CO3溶液,其作用是吸收随乙酸乙酯蒸出的少量酸性物质和乙醇.
(5)试管b中导气管不伸入液面下的原因是防止发生倒吸.
分析 a种乙醇和乙酸在浓硫酸作用下发生酯化反应生成乙酸乙酯,实验时应先加乙醇,后加浓硫酸,最后加乙酸,试管b中碳酸钠溶液可吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度,加热可加快反应速率,长导管可冷凝回流,充分利用原料,以此来解答.
解答 解:(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序及操作是先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,最后再加入冰醋酸,
故答案为:先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,最后再加入冰醋酸;
(2)液体乙酸乙醇沸点低,加热要加碎瓷片,防止暴沸,
故答案为:在试管a中加入几粒沸石(或碎瓷片);
(3)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;酯化反应;
(4)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,
故答案为:吸收随乙酸乙酯蒸出的少量酸性物质和乙醇;
(5)导管伸入饱和碳酸钠溶液中,由于乙酸和乙醇溶于饱和碳酸钠溶液,导致装置内压强急剧降低,外界大气压压着液体进入,产生倒吸现象;
故答案为;防止发生倒吸.
点评 本题考查有机物的制备实验,为高频考点,把握制备实验操作、混合物分离提纯、有机物的性质为解答的关键,侧重分析与实验能力的考查,注意实验安全的分析,题目难度不大.

练习册系列答案
相关题目
1.下列应用或事实与胶体的性质没有关系的是( )
| A. | 用明矾净化饮用水 | |
| B. | 用石膏或盐卤点制豆腐 | |
| C. | 在CuSO4溶液中逐滴加入烧碱溶液出现蓝色沉淀 | |
| D. | 用手电筒照向夜空中会出现一条光柱 |
5.硫是一种生命元素,组成某些蛋白质时离不开它.SO2是硫的一种重要氧化物,为探究SO2的性质,某化学兴趣小组的同学设计了如下系列实验:
(1)为验证SO2具有还原性.将SO2气体通入溴水中,溴水褪色.写出反应的化学方程式SO2+Br2+2H2OH2SO4+2HBr.
(2)已知与SO2Na2O2的反应为进一步探究Na2O2与SO2的反应,用如图所示装置进行实验.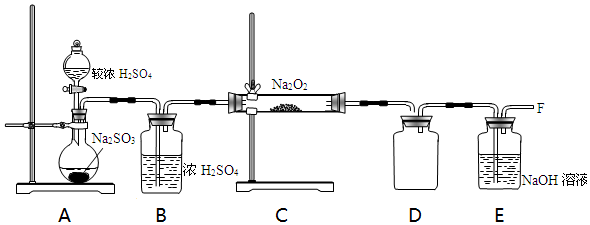
①写出A中反应的化学方程式H2SO4+Na2SO3 =Na2SO4+SO2↑+H2O.
②B装置的作用是干燥吸水.
③在F处检验到有O2生成,据此甲同学认为Na2O2与SO2发生了反应,反应的化学方程式为2Na2O2+2SO2=2Na2SO3+O2.
④乙同学认为Na2O2与SO2反应除生成Na2SO3和O2外,还有Na2SO4生成,为检验是否有Na2SO4生成,他们设计了如下实验方案.
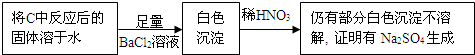
上述方案(“合理”或“不合理”)不合理,简要说明理由稀硝酸能将亚硫酸钡氧化为硫酸钡,如果反应后的固体中还残留Na2O2,它溶于水也能将亚硫酸根氧化成硫酸根.
⑤E装置中溶液呈碱性,为检验吸收液中其他阴离子,完成下列实验方案.
(1)为验证SO2具有还原性.将SO2气体通入溴水中,溴水褪色.写出反应的化学方程式SO2+Br2+2H2OH2SO4+2HBr.
(2)已知与SO2Na2O2的反应为进一步探究Na2O2与SO2的反应,用如图所示装置进行实验.

①写出A中反应的化学方程式H2SO4+Na2SO3 =Na2SO4+SO2↑+H2O.
②B装置的作用是干燥吸水.
③在F处检验到有O2生成,据此甲同学认为Na2O2与SO2发生了反应,反应的化学方程式为2Na2O2+2SO2=2Na2SO3+O2.
④乙同学认为Na2O2与SO2反应除生成Na2SO3和O2外,还有Na2SO4生成,为检验是否有Na2SO4生成,他们设计了如下实验方案.

上述方案(“合理”或“不合理”)不合理,简要说明理由稀硝酸能将亚硫酸钡氧化为硫酸钡,如果反应后的固体中还残留Na2O2,它溶于水也能将亚硫酸根氧化成硫酸根.
⑤E装置中溶液呈碱性,为检验吸收液中其他阴离子,完成下列实验方案.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量吸收液于试管中滴加BaCl2溶液至过量 | 白色浑浊 | 吸收液中存在SO32-和SO42- |
| 取步骤I中白色沉淀于试管中,加入过量的稀盐酸 | 固体部分溶解,产生气泡 |
2.若已知:
H2(g)+$\frac{1}{2}$O2(g)=H2O(g):△H=a kJ/mol
H2(g)+$\frac{1}{2}$O2(g)=H2O(l):△H=b kJ/mol
2H2O(g)=2H2(g)+O2(g):△H=c kJ/mol
关于它们的下列表述正确的是( )
H2(g)+$\frac{1}{2}$O2(g)=H2O(g):△H=a kJ/mol
H2(g)+$\frac{1}{2}$O2(g)=H2O(l):△H=b kJ/mol
2H2O(g)=2H2(g)+O2(g):△H=c kJ/mol
关于它们的下列表述正确的是( )
| A. | a+b+c=0 | B. | c=2a | C. | a>b | D. | c=a+b |
9.下列物质不属于离子化合物的是( )
| A. | KOH | B. | H2SO3 | C. | KCl | D. | NaNO3 |
6.下列说法不正确的是( )
| A. | 0.2mol/L的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-) | |
| B. | 常温下,将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,盐酸需加的水多 | |
| C. | 常温下,向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+)=c(Cl-) | |
| D. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
4.某兴趣小组利用废旧聚乳酸材料制备乳酸铝,方案如图1:
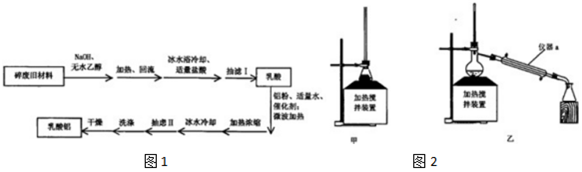
己知:①反应原理: $→_{②HCl}^{①NaOH}$CH3CH(OH)COOH$\stackrel{Al}{→}$Al[CH3CH(OH)COO]3
$→_{②HCl}^{①NaOH}$CH3CH(OH)COOH$\stackrel{Al}{→}$Al[CH3CH(OH)COO]3
乳酸常温下为易溶于水、乙醇等溶剂的液体;乳酸铝为白色或黄色粉末状固体,溶于水,不溶于乙醇等有机溶剂.
请回答:
(1)聚乳酸与NaOH加热回流合适的装置是图2甲中的甲,图2乙仪器a的名称冷凝管.
(2)其他条件不变调整乳酸溶液质量分数,以及其他条件不变调整乳酸和铝的物质的最之比,得出如下实验数据.根据实验1-3,最合适的?(乳酸)为0.20.根据实验4-6,n(乳酸):n(铝)最合适的选择为3.025,不考虑实验原料价格,最可能的理由是:超过3.025后产率变化不大,而乳酸过量较多反而使得产物杂质较多.
(3)抽滤I需对反应容器进行洗涤,并将洗涤液也抽滤.抽虑Ⅱ需对粗产品进行洗涤.所用洗涤剂最合适的分别是C.
A.抽滤I洗涤剂用热水,抽虑Ⅱ洗涤剂用冷水;
B.抽滤I洗涤剂用滤液,抽虑Ⅱ洗涤剂用滤液;
C.抽滤I洗涤剂先用滤液再用无水乙醇,抽虑Ⅱ洗涤剂用无水乙醇;
D.抽滤I洗涤剂先用无水乙醇再用滤液,抽虑Ⅱ洗涤剂先用无水乙醇再用滤液.
(4)乳酸铝纯度测定方法如下:取ag乳酸铝(相对分子质量294)样品溶解,加入缓冲溶液调节pH值,加入bmLcmol•L-1的EDTA溶液.然后加入指示剂,用d mol•L-1的标准锌溶液滴定过量的EDTA溶液.Al3+和Zn2+与EDTA均1:1反应.实验消耗标准锌溶液 emL,则乳酸铝纯度为$\frac{29.4(bc-de)}{a}%$.

己知:①反应原理:
 $→_{②HCl}^{①NaOH}$CH3CH(OH)COOH$\stackrel{Al}{→}$Al[CH3CH(OH)COO]3
$→_{②HCl}^{①NaOH}$CH3CH(OH)COOH$\stackrel{Al}{→}$Al[CH3CH(OH)COO]3乳酸常温下为易溶于水、乙醇等溶剂的液体;乳酸铝为白色或黄色粉末状固体,溶于水,不溶于乙醇等有机溶剂.
请回答:
(1)聚乳酸与NaOH加热回流合适的装置是图2甲中的甲,图2乙仪器a的名称冷凝管.
(2)其他条件不变调整乳酸溶液质量分数,以及其他条件不变调整乳酸和铝的物质的最之比,得出如下实验数据.根据实验1-3,最合适的?(乳酸)为0.20.根据实验4-6,n(乳酸):n(铝)最合适的选择为3.025,不考虑实验原料价格,最可能的理由是:超过3.025后产率变化不大,而乳酸过量较多反而使得产物杂质较多.
| 编号 | 时间/h | n(乳酸):n(铝) | ?(乳酸) | 产率(%) | 编号 | 时间/h | n(乳酸):n(铝) | ?(乳酸) | 产率(%) |
| 1 | 8 | 3.025 | 0.10 | 64.0 | 4 | 10 | 2.935 | 0.20 | 78.4 |
| 2 | 8 | 3.025 | 0.20 | 72.0 | 5 | 10 | 3.025 | 0.20 | 90.2 |
| 3 | 8 | 3.025 | 0.30 | 68.5 | 6 | 10 | 3.505 | 0.20 | 91.3 |
A.抽滤I洗涤剂用热水,抽虑Ⅱ洗涤剂用冷水;
B.抽滤I洗涤剂用滤液,抽虑Ⅱ洗涤剂用滤液;
C.抽滤I洗涤剂先用滤液再用无水乙醇,抽虑Ⅱ洗涤剂用无水乙醇;
D.抽滤I洗涤剂先用无水乙醇再用滤液,抽虑Ⅱ洗涤剂先用无水乙醇再用滤液.
(4)乳酸铝纯度测定方法如下:取ag乳酸铝(相对分子质量294)样品溶解,加入缓冲溶液调节pH值,加入bmLcmol•L-1的EDTA溶液.然后加入指示剂,用d mol•L-1的标准锌溶液滴定过量的EDTA溶液.Al3+和Zn2+与EDTA均1:1反应.实验消耗标准锌溶液 emL,则乳酸铝纯度为$\frac{29.4(bc-de)}{a}%$.
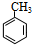 ,试剂a是浓硫酸和浓硝酸.
,试剂a是浓硫酸和浓硝酸.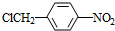 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$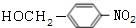 +NaCl.
+NaCl.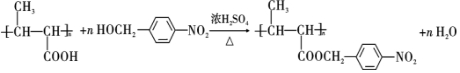 .
.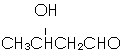 ,以E为起始原料.选用必要的无机试剂合成F,写出合成路线
,以E为起始原料.选用必要的无机试剂合成F,写出合成路线 (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).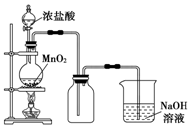 实验室中常用MnO2氧化浓盐酸的方法制取氯气,实验装置如图所示:
实验室中常用MnO2氧化浓盐酸的方法制取氯气,实验装置如图所示: