题目内容
18. 现有如下溶液:①1.0mL0.10mol•L-1双氧水 ②1.0mL0.20mol•L-1双氧水 ③3.0mL0.10mol•L-1KMnO4溶液 ④3.0mL0.010mol•L-1KMnO4溶液.所有实验均需加入1.0mL稀硫酸(足量),依据褪色时间长短判定反应速率快慢:
现有如下溶液:①1.0mL0.10mol•L-1双氧水 ②1.0mL0.20mol•L-1双氧水 ③3.0mL0.10mol•L-1KMnO4溶液 ④3.0mL0.010mol•L-1KMnO4溶液.所有实验均需加入1.0mL稀硫酸(足量),依据褪色时间长短判定反应速率快慢:(1)写出发生反应的离子方程式2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O;
若某反应的化学方程式为2KMnO4+9H2O2+3H2SO4═K2SO4+2MnSO4+7O2↑+12H2O,则该反应的氧化剂为KMnO4、H2O2,若有9molH2O2参加该反应,则反应转移电子数目为14NA;
(2)某温度下,若要探究反应物浓度对反应速率的影响,则应选择试剂①②④进行实验(填序号).
(3)某温度下,某同学按照(2)中选择试剂进行实验,褪色时间为5s:
①计算以H2O2表示的反应速率为3.0×10-3mol•L-1•S-1;
②进行实验过程中,该同学发现颜色变化会出现先慢后快并突然褪色的现象.为此该同学又进行了一次平行实验,只是加入少量MnSO4固体,结果溶液立即褪色,请推测颜色变化会出现先慢后快并突然褪色的现象的原因MnSO4为该反应的催化剂;
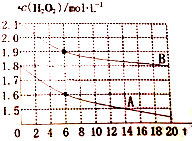
(4)某同学在不同温度下,分别取两份等体积不同浓度的双氧水与等量KMnO4溶液进行反应,绘制出c(H2O2)随时间(t)变化的曲线如图所示,若A、B分别为不同温度时测定的曲线,则A(填“A”或“B”)曲线所对应的实验温度高,判断的依据是A曲线起始浓度小,但在0~6s内平均反应加快,说明其温度高.
分析 (1)高锰酸钾与双氧水反应,生成氧气和锰离子,发生反应的离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O;在2KMnO4+9H2O2+3H2SO4═K2SO4+2MnSO4+7O2↑+12H2O反应,锰元素的化合价降低,过氧化氢中部分氧元素化合价降低,所以该反应的氧化剂为KMnO4和H2O2,若有9molH2O2参加该反应,只有7mol是还原剂,所以转移电子的数目为 14NA;
(2)可表明反应物浓度对反应速率产生影响的是实验,其它数据应相同;
(3)①根据v=$\frac{△c}{△t}$,进行计算求解;
②说明生成的MnSO4为该反应的催化剂;
(4)温度越高反应速率越快,单位时间内浓度变化量大,所以A对应的曲线温度高,具体原因是 A曲线起始浓度小,但在0~6s内平均反应加快,说明其温度高.
解答 解:(1)高锰酸钾与双氧水反应,生成氧气和锰离子,发生反应的离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O;在2KMnO4+9H2O2+3H2SO4═K2SO4+2MnSO4+7O2↑+12H2O反应,锰元素的化合价降低,过氧化氢中部分氧元素化合价降低,所以该反应的氧化剂为KMnO4和H2O2,若有9molH2O2参加该反应,只有7mol是还原剂,所以转移电子的数目为 14NA,故答案为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O; KMnO4、H2O2;14NA;
(2)可选择过氧化氢的浓度不同,而高锰酸钾浓度相同,且高锰酸钾的浓度不宜太大,所以选①②④,故答案为:①②④;
(3)①过氧化氢物质的量的变化量为:$\frac{3×0.01×1{0}^{-3}×5}{2}$=7.5×10-5mol,根据v=$\frac{△c}{△t}$=$\frac{\frac{7.5×1{0}^{-5}}{5×1{0}^{-3}}mol/L}{5s}$=3.0×10-3mol•L-1•S-1,故答案为:3.0×10-3mol•L-1•S-1;
②说明生成的MnSO4为该反应的催化剂,故答案为:MnSO4为该反应的催化剂;
(4)温度越高反应速率越快,单位时间内浓度变化量大,所以A对应的曲线温度高,具体原因是 A曲线起始浓度小,但在0~6s内平均反应加快,说明其温度高,故答案为:A;A曲线起始浓度小,但在0~6s内平均反应加快,说明其温度高.
点评 本题探究影响化学反应速率的因素,侧重于学生的分析能力的考查,为高频考点,关键是分析、提取题中数据的能力,本题难度适中.

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案| A. | 这是一种矿物胶,既不燃烧也不受腐蚀 | |
| B. | 在建筑工业上可以作黏合剂、耐酸水泥掺料 | |
| C. | 木材、织物浸过水玻璃后具有防腐性能且不易燃烧 | |
| D. | 水玻璃的化学性质稳定,在空气中不易变质 |
| A. | 明矾和氢氧化钡溶液 | B. | 钠和MgC12溶液 | ||
| C. | 铜粉和FeC13溶液 | D. | Na2O2和少量FeCl2溶液 |
| A. | CO+H2O═CO2+H2 | B. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||
| C. | 2F2+2H2O═4HF+O2 | D. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
| A. | 高纯硅用于制造光导纤维,实现光电信号转化 | |
| B. | 石英中无色透明的晶体就是通常所说的水晶,其主要成分是二氧化硅 | |
| C. | 光导纤维导光的能力很强,是非常好的通讯材料 | |
| D. | 硅胶多孔,吸附水能力强,可以用作催化剂的载体 |

| A. | ①加CCl4 ②加苯 ③加酒精 | |
| B. | ①加酒精 ②加CCl4 ③加苯 | |
| C. | ①加苯 ②加CCl4 ③加酒精 | |
| D. | ①加苯 ②加酒精 ③加CCl4 |
| A. | 阳极:Cu-2e-═Cu2+ 阴极:Cu2++2e-═Cu | |
| B. | 阳极:2Cu+2I--2e-═2CuI 阴极:2H++2e-═H2↑ | |
| C. | 阳极:2I--2e-═I2 阴极:2H++2e-═H2↑ | |
| D. | 阳极:4OH--4e-═2H2O+O2↑ 阴极:4H++4e-═2H2↑ |