题目内容
6.下列各组物质混合后,既有气体又有白色沉淀生成的是( )| A. | 明矾和氢氧化钡溶液 | B. | 钠和MgC12溶液 | ||
| C. | 铜粉和FeC13溶液 | D. | Na2O2和少量FeCl2溶液 |
分析 A.发生复分解反应生成硫酸钡沉淀;
B.钠与水反应生成氢气和NaOH,NaOH与氯化镁生成氢氧化镁沉淀;
C.铜粉和FeC13溶液生成氯化铜和氯化亚铁;
D.过氧化钠与水反应生成氧气和NaOH,FeCl2被氧化,与NaOH反应生成氢氧化铁沉淀.
解答 解:A.明矾和氢氧化钡溶液,当氢氧化钡过量反应只生成硫酸钡沉淀,只观察到白色沉淀,故A不选;
B.钠与水反应生成氢气和NaOH,NaOH与氯化镁生成氢氧化镁白色沉淀,则既产生无色气体,又生成白色沉淀,故B选;
C.铜粉和FeC13溶液生成氯化铜和氯化亚铁,没有气体生成,也无沉淀生成,故C不选;
D.过氧化钠与水反应生成氧气和NaOH,FeCl2被氧化,与NaOH反应生成氢氧化铁红褐色沉淀,既产生无色气体,又生成红褐色沉淀,故D不选;
故选B.
点评 本题考查物质的性质及相互转化,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.下列指定反应的离子方程式不正确的是( )
| A. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 电解熔融氧化铝:2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑ | |
| C. | NaHCO3溶液与稀H2SO4反应:HCO3-+H+═H2O+CO2↑ | |
| D. | 向Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
17.利用金属活性的不同,可以采取不同的冶炼方法冶炼金属.下列反应所描述的冶炼方法不可能实现的是( )
| A. | 2AlCl3(熔融) $\frac{\underline{\;电解\;}}{冰晶}$ 4Al+3Cl2↑ | |
| B. | Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 | |
| C. | Fe+CuSO4═FeSO4+Cu | |
| D. | 2KCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2K+Cl2↑ |
14.“绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的负作用.下列化学反应中,不符合绿色化学概念的是( )
| A. | 消除制硝酸工业尾气中的氮氧化物的污染:NO+NO2+2NaOH═2NaNO2+H2O | |
| B. | 消除硫酸厂尾气中的SO2:SO2+2NH3•H2O═(NH4)2SO3+H2O | |
| C. | 用反应: 制备环氧乙烷 制备环氧乙烷 | |
| D. | 制CuSO4:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O |
11.如表对有关实验事实的解释或得出的结论合理的是( )
| 选项 | 实验事实 | 解释或结论 |
| A | KI淀粉溶液中滴入氯水变蓝,再通入SO2,溶液褪色 | SO2具有漂白性 |
| B | 将NaHCO3和NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| C | 某钾盐溶于盐酸,产生无色无味气体,该气体通入 澄清石灰水,有白色沉淀出现 | 该钾盐是K2CO3 |
| D | NaI溶液$\stackrel{30%H_{2}O_{2}溶液}{→}$$\stackrel{稀硝酸及淀粉}{→}$溶液变蓝色 | 酸性条件下H2O2的氧化性比I2强 |
| A. | A | B. | B | C. | C | D. | D |
11.关于可逆反应X2(g)+3Y2(g)?2XY3(g)△H<0,下列叙述正确的是( )
| A. | 降低温度可以缩短反应达到平衡的时间 | |
| B. | 恒容时通入氩气,压强增大,平衡向右移动 | |
| C. | 恒容时通入X2,平衡向正反应方向移动,平衡常数不变 | |
| D. | 恒温恒压下,若混合气体密度不变,说明反应已达平衡 |
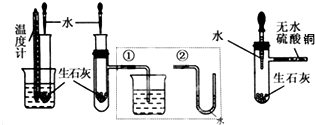
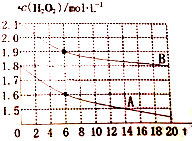 现有如下溶液:①1.0mL0.10mol•L-1双氧水 ②1.0mL0.20mol•L-1双氧水 ③3.0mL0.10mol•L-1KMnO4溶液 ④3.0mL0.010mol•L-1KMnO4溶液.所有实验均需加入1.0mL稀硫酸(足量),依据褪色时间长短判定反应速率快慢:
现有如下溶液:①1.0mL0.10mol•L-1双氧水 ②1.0mL0.20mol•L-1双氧水 ③3.0mL0.10mol•L-1KMnO4溶液 ④3.0mL0.010mol•L-1KMnO4溶液.所有实验均需加入1.0mL稀硫酸(足量),依据褪色时间长短判定反应速率快慢: