题目内容
13.下列反应与Br2+SO2+2H2O═2HBr+H2SO4相比较,水在氧化还原反应中的作用与其相同的是( )| A. | CO+H2O═CO2+H2 | B. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||
| C. | 2F2+2H2O═4HF+O2 | D. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
分析 Br2+SO2+2H2O═2HBr+H2SO4中Br元素的化合价降低、S元素的化合价升高,为氧化还原反应,且水既不是氧化剂也不是还原剂,结合选项中元素的化合价变化判断.
解答 解:Br2+SO2+2H2O═2HBr+H2SO4中Br元素的化合价降低、S元素的化合价升高,为氧化还原反应,且水既不是氧化剂也不是还原剂,
A.水中H元素的化合价降低,水为氧化剂,故A不选;
B.Fe元素的化合价升高,氧气中氧元素的化合价降低,为氧化还原反应,且水既不是氧化剂也不是还原剂,故B选;
C.水中O元素的化合价升高,水为还原剂,故C不选;
D.水中H元素的化合价降低,水为氧化剂,故D不选;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意常见元素化合价的判断,选项D为易错点,题目难度不大.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
4.下列有机化学反应中属于取代反应的是( )
| A. | CH2═CH2+Cl2→CH2ClCH2Cl | B. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | ||
| C. | 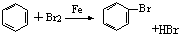 | D. | 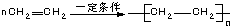 |
8.在含有Fe3+、Fe2+、Al3+、NH4+的稀溶液中加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,完全反应后,离子数几乎没有变化的是( )
| A. | Fe3+、Al3+ | B. | Al3+ | C. | Fe2+、Al3+ | D. | NH4+ |
5.某溶液加入金属铝能放出氢气.下列各组离子在该溶液中一定可以大量共存的是( )
| A. | Al3+、NH4+、Cl-、SO42- | B. | Na+、Cl-、SO42-、HCO3- | ||
| C. | Na+、CH3COO-、NO3-、K+ | D. | K+、Na+、Cl-、SO42- |
2.下列叙述错误的是( )
| A. | 若向2mL 1mol/LNaOH溶液中先加入2滴1mol/L MgCl2溶液,再加入2滴1mol/L的FeCl3溶液,可以证明Mg(OH)2沉淀转化为Fe(OH)3沉淀 | |
| B. | 常温下,某溶液中由水电离出来的c(OH-)=1.0×10-12mol•L-1,则该溶液可能为盐酸,也可能为NaOH溶液 | |
| C. | 处理锅炉水垢中的CaSO4时,依次加入饱和NaCO3溶液和盐酸,水垢溶解,说明溶解度:S(CaCO3)<S(CaSO4) | |
| D. | 常温下的醋酸铵溶液呈中性,则溶液中c(H+)=c(OH-)=1.0×10-7mol•L-1 |
18.下列化学方程式中,不能用离子方程式 Ba2++SO42-=BaSO4↓表示的是( )
| A. | BaCl2+Na2SO4=BaSO4↓+2NaCl | B. | H2SO4+BaCl2═BaSO4↓+2HCl | ||
| C. | Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 | D. | BaCO3+H2SO4=BaSO4↓+CO2↑+H2O |
 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.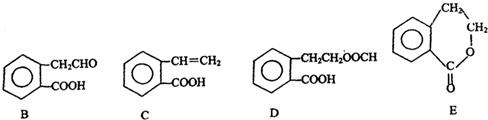
 .
. .
.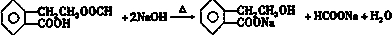 .
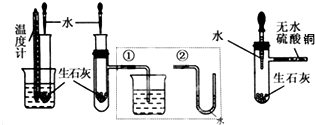
.
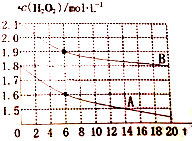 现有如下溶液:①1.0mL0.10mol•L-1双氧水 ②1.0mL0.20mol•L-1双氧水 ③3.0mL0.10mol•L-1KMnO4溶液 ④3.0mL0.010mol•L-1KMnO4溶液.所有实验均需加入1.0mL稀硫酸(足量),依据褪色时间长短判定反应速率快慢:
现有如下溶液:①1.0mL0.10mol•L-1双氧水 ②1.0mL0.20mol•L-1双氧水 ③3.0mL0.10mol•L-1KMnO4溶液 ④3.0mL0.010mol•L-1KMnO4溶液.所有实验均需加入1.0mL稀硫酸(足量),依据褪色时间长短判定反应速率快慢: