��Ŀ����
8��FeCl3���о�ˮ���ã�����ʴ�豸�����ۺ��Ȼ�����һ�����͵���������������ˮ��FeCl3��Ч���Ҹ�ʴ��С������ˮ���������и������μ�ClO2����ش��������⣺��1������������һ����ɫ��ˮ��������Ч�ɷ��Ǹ������[��FeO4��]2-�������������ܾ�ˮ����������������ˮԭ��������������Ԫ��Ϊ+6�ۣ���ǿ�����ԣ�����ɱ��������������ԭ������Fe3+����ˮ��Ϊ�����������壬���ܾ�ˮ����ҵ�ϳ���ǿ���Խ�������NaClO����Fe��OH��3���ɸ������ơ��Ȼ��ƣ��÷�Ӧ�����ӷ���ʽΪ2Fe3++3ClO-+10OH-=2FeO42-+5H2O+3Cl-��
��2��ClO2��һ�ָ�Ч���Ͷ�������������ҵ�Ͽ���KC1O3��Na2SO3��H2SO4�������Ƶ�ClO2���÷�Ӧ�������뻹ԭ�����ʵ���֮��Ϊ2��1��
��3������ʵ�����Ʊ�������������ķ��������ձ��е�ˮ�����ڣ����ˮ�μӼ��α����Ȼ�����Һ�������������Һ�ʺ��ɫ����ֹͣ���� ��д����Ӧ���ӷ���ʽFeCl3+3H2O$\frac{\underline{\;��\;}}{\;}$Fe��OH��3�����壩+3HCl��
��4��Ϊ��Լ�ɱ�����ҵ����NaClO3 ��������FeCl2 ��Һ�õ�FeCl3��
1ClO3-+6Fe2++6��H+�T6 Fe3++1 Cl-+3��H2O��
ʵ���ҳ���KSCN��Һ���Fe3+�Ĵ��ڣ����ʱ�۲쵽��Һ��� ����ʱ������Ϊ����Fe3+������������ҵ��ȡFeCl3��ȡ��Ӧ�����Һ����μ�������Ƿ���Fe2+���軯����Һ�����������Լ���ʵ����������ɫ���������������ӣ�
���� ��1��������������Ԫ��Ϊ+6�ۣ���ǿ�����ԣ�����ԭ������Fe3+���ܾ�ˮ���ڼ��������£�����NaClO�������������Ƶ�Na2FeO4����ϵ���غ��ԭ���غ���ƽ��д���ӷ���ʽ��
��2��KClO3��H2SO4��������Na2SO3��Ӧ��SO32-��������SO42-���ɵ��ӡ�����غ��֪�����ӷ�ӦΪ2ClO3-+SO32-+2H+�T2ClO2+SO42-+H2O��
��3�����������Ȼ�����Һ���˷�ˮ������ȡ�����������壻
��4���������������Ե��Ȼ���������Ӧ�����������Ӳμӣ�������������ˮ���ɣ�ClԪ�صĻ��ϼ۴�+5�۽��͵�-1�ۣ��õ�6�����ӣ���FeԪ�صĻ��ϼ۴�+2�����ߵ�+3�ۣ�ʧȥ1�����ӣ����ݵ�ʧ�����غ㣬����������ӵ�ϵ��Ϊ1��Fe2+��ϵ��Ϊ6���������ӵ�ϵ��Ҳ��6�������ӵ�ϵ����1�����ݵ���غ㣬�������ӵ�ϵ����6��ˮ��ϵ����3��
���Fe3+�Ĵ���ͨ����KSCN��Һ����������Һ��죻Fe2+�����軯��������ɫ������
��� �⣺��1��������������Ԫ��Ϊ+6�ۣ���ǿ�����ԣ�����ɱ��������������ԭ������Fe3+����ˮ��Ϊ�����������壬���ܾ�ˮ���ڼ��������£�����NaClO�������������Ƶ�Na2FeO4���÷�Ӧ�����ӷ�Ӧ����ʽΪ2Fe3++3ClO-+10OH-=2FeO42-+5H2O+3Cl-��
�ʴ�Ϊ��������������Ԫ��Ϊ+6�ۣ���ǿ�����ԣ�����ɱ��������������ԭ������Fe3+����ˮ��Ϊ�����������壬���ܾ�ˮ��2Fe3++3ClO-+10OH-=2FeO42-+5H2O+3Cl-��
��2��KClO3��H2SO4��������Na2SO3��Ӧ�Ƶ�ClO2����֪SO32-��������SO42-���ɵ��ӡ�����غ��֪�����ӷ�ӦΪ2ClO3-+SO32-+2H+�T2ClO2+SO42-+H2O��������ΪKClO3����ԭ��ΪNa2SO3�������ӷ�Ӧ��֪�÷�Ӧ�������뻹ԭ�����ʵ���֮��Ϊ2��1���ʴ�Ϊ��2��1��
��3��ʵ�����Ʊ�������������ķ����ǣ������ձ��е�ˮ�����ڣ����ˮ�μӼ��α����Ȼ�����Һ�������������Һ�ʺ��ɫ����ֹͣ���ȣ�Ҫע��ʵ����̲����ò��������裬������Һ���ֻ��ǣ�����Ӧ��ϵ���ֺ��ɫ�����Ƶ������������壬Ӧ����ֹͣ���ȣ�����Ҳ���׳��ֻ��ǣ��������ɫ��������������������ˮ�еμӱ����Ȼ�����Һ����������У������˳�ʱ����ȣ���Ӧԭ��Ϊ��FeCl3+3 H2O$\frac{\underline{\;��\;}}{\;}$Fe��OH��3�����壩+3HCl��
�ʴ�Ϊ�������ձ��е�ˮ�����ڣ����ˮ�μӼ��α����Ȼ�����Һ�������������Һ�ʺ��ɫ����ֹͣ���ȣ�FeCl3+3H2O$\frac{\underline{\;��\;}}{\;}$Fe��OH��3�����壩+3HCl��
��4���������������Ե��Ȼ���������Ӧ�����������Ӳμӣ�������������ˮ���ɣ�ClԪ�صĻ��ϼ۴�+5�۽��͵�-1�ۣ��õ�6�����ӣ���FeԪ�صĻ��ϼ۴�+2�����ߵ�+3�ۣ�ʧȥ1�����ӣ����ݵ�ʧ�����غ㣬����������ӵ�ϵ��Ϊ1��Fe2+��ϵ��Ϊ6���������ӵ�ϵ��Ҳ��6�������ӵ�ϵ����1�����ݵ���غ㣬�������ӵ�ϵ����6��ˮ��ϵ����3����ƽ�����ӷ���ʽΪ��ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O��
���Fe3+�Ĵ���ͨ����KSCN��Һ�������ǵ���KSCN��Һ����Һ��죻Fe2+�����軯��������ɫ�������ʼ��FeCl3���Ƿ���Fe2+��Ӧ�������軯����Һ����������ɫ��������Fe2+��������
�ʴ�Ϊ��1��6��6H+��6��1��3H2O��KSCN��Һ����Һ��죻���軯����Һ��������ɫ���������������ӣ�
���� ���⿼�����Ļ��������ʵ�Ӧ�á�������ԭ��Ӧ����ʽ����ƽ��ƽ���ƶ�Ӱ�����صȣ���Ҫѧ���߱���ʵ�Ļ�������������Ѷȣ��Ѷ��еȣ�

 100�ִ�����ĩ���ϵ�д�
100�ִ�����ĩ���ϵ�д�| A�� | CO�Ļ�ԭ��ǿ��Pd | |
| B�� | ��Ӧ��PdCl2������ | |
| C�� | ����Ӧ����22.4 L CO2����ת�Ƶ��ӵ����ʵ���һ��Ϊ2 mol | |
| D�� | CO����ֻ���ڸ����²��ܱ��ֳ���ԭ�� |
| A�� | ��Al2��SO4��3��Һ�м��������ˮ��Al3++3NH3•H2O�TAl��OH��3��+3NH4+ | |
| B�� | ���������������2Al2O3�����ڣ�$\frac{\underline{\;ͨ��\;}}{\;}$4Al+3O2�� | |
| C�� | NaHCO3��Һ��ϡH2SO4��Ӧ��HCO3-+H+�TH2O+CO2�� | |
| D�� | ��Ca��HCO3��2��Һ�м�������NaOH��Һ��Ca2++HCO3-+OH-�TCaCO3��+H2O |
| A�� | ������Ӧ�н�����ʧȥ����0.1mol | |
| B�� | �Ͻ��У�ͭ������Ϊ2.8g | |
| C�� | ԭ�����Ũ�ȣ�c��HNO3��=4.5mol•L-1 | |
| D�� | Ҫʹ��Һ�еĽ���������ȫ���������5mol•L-1��NaOH��Һ60mL |
| A�� | 2AlCl3�����ڣ� $\frac{\underline{\;���\;}}{����}$ 4Al+3Cl2�� | |
| B�� | Fe2O3+3CO $\frac{\underline{\;����\;}}{\;}$ 2Fe+3CO2 | |
| C�� | Fe+CuSO4�TFeSO4+Cu | |
| D�� | 2KCl�����ڣ�$\frac{\underline{\;���\;}}{\;}$2K+Cl2�� |
 ������ͨ����ͬ��ѧ��Ӧ�ֱ��Ƶ�B��C��D��E�������ʣ�
������ͨ����ͬ��ѧ��Ӧ�ֱ��Ƶ�B��C��D��E�������ʣ�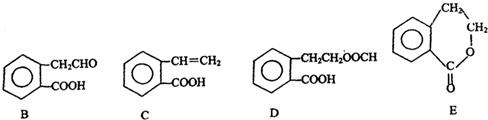
 ��
�� ��
��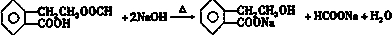 ��
��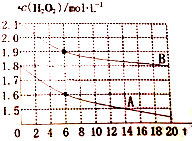 ����������Һ����1.0mL0.10mol•L-1˫��ˮ ��1.0mL0.20mol•L-1˫��ˮ ��3.0mL0.10mol•L-1KMnO4��Һ ��3.0mL0.010mol•L-1KMnO4��Һ������ʵ��������1.0mLϡ���ᣨ��������������ɫʱ�䳤���ж���Ӧ���ʿ�����
����������Һ����1.0mL0.10mol•L-1˫��ˮ ��1.0mL0.20mol•L-1˫��ˮ ��3.0mL0.10mol•L-1KMnO4��Һ ��3.0mL0.010mol•L-1KMnO4��Һ������ʵ��������1.0mLϡ���ᣨ��������������ɫʱ�䳤���ж���Ӧ���ʿ�����