题目内容
1.不同温度下BaCO3在水中的沉淀溶解平衡曲线如图所示(已知T1<T2<T3),下列说法正确的是( )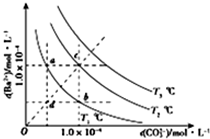
| A. | T2温度下将d点的溶液蒸发浓缩可变为c点 | |
| B. | a点的Ksp小于B点的Ksp | |
| C. | b点溶液中加入BaCl2固体可变为c点 | |
| D. | a点溶液蒸发浓缩恢复到原温度可变为b点 |
分析 A.d点的含义为T2温度下,溶液中的离子积Qc<Ksp(T1),为不饱和溶液,蒸发浓缩可变为饱和溶液;
B.温度相同,则溶度积常数相同;
C.加入BaCl2固体,相当于增加溶液中的Ba2+的浓度,b点时溶液T1温度下的为饱和溶液,增加Ba2+的浓度,反应向生成沉淀的方向进行;
D.a点时温度为T2下的饱和溶液,溶液蒸发浓缩恢复到原温度析出晶体,溶液中不可能CO32-的浓度会增加.
解答 解:A.d点的含义为T2温度下,溶液中的离子积Qc<Ksp(T1),为不饱和溶液,蒸发浓缩可变为饱和溶液,c为T1温度下的饱和溶液,则T2温度下将d点的溶液蒸发浓缩可变为c点,故A正确;
B.a点和b点时的温度均为T2,温度相同,溶度积常数相同,则a点的Ksp等于b点的Ksp,故B错误;
C.加入BaCl2固体,相当于增加溶液中的Ba2+的浓度,b点时溶液为T1温度下的饱和溶液,增加Ba2+的浓度,反应向生成沉淀的方向进行,但不可能变为温度为T2下的饱和溶液c点,故C错误;
D.a点时温度为T2下的饱和溶液,溶液蒸发浓缩恢复到原温度析出晶体,溶液中不可能CO32-的浓度会增加,则不可能变为b点,故D错误.
故选A.
点评 本题考查沉淀溶解平衡知识,结合图象和溶度积常数分析是解题的关键,题目难度不大.

练习册系列答案
相关题目
16.如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )


| A. | 原子半径:Z>Y>X | |
| B. | 气态氢化物的稳定性:W>R | |
| C. | WX3和水反应形成的化合物是离子化合物 | |
| D. | Y和Z两者最高氧化物对应的水化物能相互反应 |
17.下列比较正确的是( )
| A. | 熔沸点高低:CH4<SiH4<GeH4<SnH4 | |
| B. | 离子半径大小:Cl-<Mg2+<O2-<F- | |
| C. | 分散质微粒直径大小:Fe(OH)3胶体>CaCO3悬浊液>NaCl溶液 | |
| D. | 酸性强弱:H2SO4<H3PO4<H2SiO3 |
14.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 0.5mol熔融的NaHSO4中含有的离子数目为1.5NA | |
| B. | 标准状况下,2.24LCl2溶于水,转移电子数为0.1NA | |
| C. | 氢气与氯气反应生成标准状况下22.4L氯化氢,则断裂化学键总数为NA | |
| D. | 电解精练铜时,转移1mol电子时,阳极溶解的铜的质量为32g |
1.能正确表示下列反应的离子方程式的是( )
| A. | 将铜屑加入 Fe3+溶液中:2Fe3++Cu=2Fe2++Cu2+ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 将氯化亚铁酸性溶液和H2O2混合:Fe2++2H++H2O2═Fe3++2H2O | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
6.CO2的转换在生产、生活中具有重要的应用.
(1)CO2的低碳转型对抵御气候变化具有重要意义,海洋是地球上碳元素最大的“吸收池”.
①溶于海水中的CO2主要以四种无机碳形式存在,除CO2、H2CO3两种分子外,还有两种离子的化学式为HCO3-、CO32-.
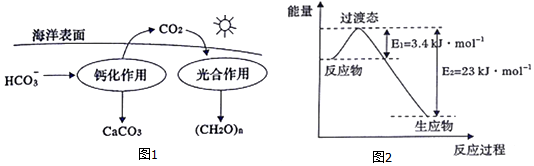
②在海洋碳循环中,可通过图1所示的途径固碳.写出钙化作用的离子方程式:Ca2++2HCO3-═CaCO3↓+CO2↑+H2O.
(2)将CO2与金属钠组合设计成Na-CO2电池,很容易实现可逆的充、放电反应,该电池反应为4Na+3CO2 $?_{放电}^{放电}$2Na2CO3+C.放电时,在正极得电子的物质为CO2;充电时,阳极的反应式为C-4e-+2CO32-═3CO2.
(3)目前工业上有一种方法是用CO2和H2在230℃并有催化剂条件下转化生成甲醇蒸汽和水蒸气.图2表示恒压容器中0.5molCO2和1.5mol H2转化率达80%时的能量变化示意图.能判断该反应达到化学平衡状态的依据B、D(填字母).
A.容器中压强不变 B.H2的体积分数不变
C.c(H2=3c(CH3OH) D.容器中密度不变
E.2个C=O断裂的同时有6个H-H断裂
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表三组数据:
①实验2条件下平衡常数K=$\frac{1}{6}$.
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值<1 (填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时v(正<v(逆)(填“<”、“>”或“=“).
(5)已知在常温常压下:
①2CH3OH(I)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
③H2O(g)=H2O(I)△H=-44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8kJ/mol.
(1)CO2的低碳转型对抵御气候变化具有重要意义,海洋是地球上碳元素最大的“吸收池”.
①溶于海水中的CO2主要以四种无机碳形式存在,除CO2、H2CO3两种分子外,还有两种离子的化学式为HCO3-、CO32-.
②在海洋碳循环中,可通过图1所示的途径固碳.写出钙化作用的离子方程式:Ca2++2HCO3-═CaCO3↓+CO2↑+H2O.
(2)将CO2与金属钠组合设计成Na-CO2电池,很容易实现可逆的充、放电反应,该电池反应为4Na+3CO2 $?_{放电}^{放电}$2Na2CO3+C.放电时,在正极得电子的物质为CO2;充电时,阳极的反应式为C-4e-+2CO32-═3CO2.
(3)目前工业上有一种方法是用CO2和H2在230℃并有催化剂条件下转化生成甲醇蒸汽和水蒸气.图2表示恒压容器中0.5molCO2和1.5mol H2转化率达80%时的能量变化示意图.能判断该反应达到化学平衡状态的依据B、D(填字母).

A.容器中压强不变 B.H2的体积分数不变
C.c(H2=3c(CH3OH) D.容器中密度不变
E.2个C=O断裂的同时有6个H-H断裂
(4)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值<1 (填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时v(正<v(逆)(填“<”、“>”或“=“).
(5)已知在常温常压下:
①2CH3OH(I)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
③H2O(g)=H2O(I)△H=-44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8kJ/mol.
13.已知 ,
, 叫狄尔斯阿德而反应,用 于构建六元环,则下列说法不正确的是( )
叫狄尔斯阿德而反应,用 于构建六元环,则下列说法不正确的是( )
 ,
, 叫狄尔斯阿德而反应,用 于构建六元环,则下列说法不正确的是( )
叫狄尔斯阿德而反应,用 于构建六元环,则下列说法不正确的是( )| A. | 狄尔斯阿德而反应为加成反应,原子利用率为100% | |
| B. |  可通过狄尔斯阿德而反应合成,而 可通过狄尔斯阿德而反应合成,而 不可通过狄尔斯阿德而反应合成 不可通过狄尔斯阿德而反应合成 | |
| C. | 2-甲基-1,3-丁二烯和丙炔发生上述反应产物有两种 | |
| D. |  可由环戊二烯与丙烯酸甲酯发生上述反应得到 可由环戊二烯与丙烯酸甲酯发生上述反应得到 |
11.下列有关实验操作和现象、结论都正确的是( )
| 选项 | 实验操作和现象 | 实验结论 |
| A | 常温下,将大小、形状形态的锌和铝分别加入到等体积98%的浓硫酸中,观察到前者反应速率快 | 锌比铝活泼 |
| B | 向某溶液中加入盐酸酸化的氯化钡溶液,产生白色沉淀 | 该溶液中一定含有SO42- |
| C | 将盐酸滴入碳酸钠溶液中,产生气泡 | 非金属性:Cl大于C |
| D | 向某溶液中加入氢氧化钡溶液丙加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该溶液中一定含有NH4+ |
| A. | A | B. | B | C. | C | D. | D |