题目内容
13.已知 ,
, 叫狄尔斯阿德而反应,用 于构建六元环,则下列说法不正确的是( )
叫狄尔斯阿德而反应,用 于构建六元环,则下列说法不正确的是( )| A. | 狄尔斯阿德而反应为加成反应,原子利用率为100% | |
| B. |  可通过狄尔斯阿德而反应合成,而 可通过狄尔斯阿德而反应合成,而 不可通过狄尔斯阿德而反应合成 不可通过狄尔斯阿德而反应合成 | |
| C. | 2-甲基-1,3-丁二烯和丙炔发生上述反应产物有两种 | |
| D. |  可由环戊二烯与丙烯酸甲酯发生上述反应得到 可由环戊二烯与丙烯酸甲酯发生上述反应得到 |
分析 A.反应中C=C生成C-C键以及C≡C生成C=C键;
B.可发生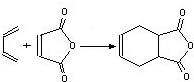 生成;
生成;
C.2-甲基-1,3-丁二烯和丙烯结构不对称,发生上述反应产物可能有2种;
D.由题给信息可知 对应的反应物分别含有2个碳碳双键、且为环状化合物,另一种反应物含有碳碳双键和酯基.
对应的反应物分别含有2个碳碳双键、且为环状化合物,另一种反应物含有碳碳双键和酯基.
解答 解:A.反应中C=C生成C-C键以及C≡C生成C=C键,为加成反应,故A正确;
B. 可由
可由 反应生成,故B错误;
反应生成,故B错误;
C.2-甲基-1,3-丁二烯和丙烯结构不对称,发生上述反应产物可能有2种,故C正确;
D.由题给信息可知 对应的反应物分别含有2个碳碳双键、且为环状化合物,另一种反应物含有碳碳双键和酯基,分别为环戊二烯与丙烯酸甲酯,故D正确.
对应的反应物分别含有2个碳碳双键、且为环状化合物,另一种反应物含有碳碳双键和酯基,分别为环戊二烯与丙烯酸甲酯,故D正确.
故选B.
点评 本题主要考查有机物的合成,为高频考点,侧重于学生的分析能力的考查,题目侧重有机反应方程式的书写,难度中等,易错点为对信息的理解,注意正确推断有机物的结构为解答该题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.如图所示装置中图1灯泡不亮,图2灯泡发亮,由此得出的结论是( )


| A. | NaCl溶液能导电,是电解质 | |
| B. | 电解质在电流的作用下才能发生电离 | |
| C. | 水是电解质,能产生大量的H+和OH- | |
| D. | NaCl溶液中存在大量自由移动的Na+和Cl- |
9.有一系列有机物分子,每个碳原子与周围3个碳原子形成碳碳单键,碳原子剩余价键被氢原子饱和.其中甲、乙、丙三种有机物结构如图所示,下列关于它们的描述正确的是( )

| A. | 甲、乙、丙组成结构相似,互为同系物 | |
| B. | 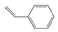 是丙的同分异构体 是丙的同分异构体 | |
| C. | 乙的二氯代物有4种 | |
| D. | 甲、乙、丙均为不饱和烃,它们都能使溴的CCl4溶液褪色 |
1.不同温度下BaCO3在水中的沉淀溶解平衡曲线如图所示(已知T1<T2<T3),下列说法正确的是( )
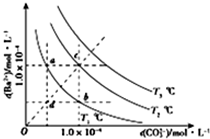

| A. | T2温度下将d点的溶液蒸发浓缩可变为c点 | |
| B. | a点的Ksp小于B点的Ksp | |
| C. | b点溶液中加入BaCl2固体可变为c点 | |
| D. | a点溶液蒸发浓缩恢复到原温度可变为b点 |
8. 常温下用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1CH3COOH(Ka=1.75×10-5)溶液和HCN(Ka=4.9×10-10)溶液所得滴定曲线如图.下列说法正确的是( )
常温下用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1CH3COOH(Ka=1.75×10-5)溶液和HCN(Ka=4.9×10-10)溶液所得滴定曲线如图.下列说法正确的是( )
 常温下用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1CH3COOH(Ka=1.75×10-5)溶液和HCN(Ka=4.9×10-10)溶液所得滴定曲线如图.下列说法正确的是( )
常温下用0.10mol•L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol•L-1CH3COOH(Ka=1.75×10-5)溶液和HCN(Ka=4.9×10-10)溶液所得滴定曲线如图.下列说法正确的是( )| A. | 曲线I和曲线II分别代表的是CH3COOH和HCN | |
| B. | 点③和点⑤所示溶液中由水电离出的c(H+):⑤>③ | |
| C. | 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH) | |
| D. | 在点②和③之间(不包括端点)存在关系:c(Na+)>c(A-)>c(H+)>c(OH-) (A-代表溶液中的酸根离子) |
18.下列对乙烯和和聚乙烯的描述中,不正确的是( )
| A. | 乙烯是纯净物,聚乙烯是混合物,都能使酸性KMnO4溶液褪色 | |
| B. | 取等质量的乙烯和和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 | |
| C. | 常温下乙烯为气态,聚乙烯为固态 | |
| D. | 乙烯可以发生加成聚合反应生成聚乙烯,聚乙烯的单体是乙烯 |
5.下列变化属于物理变化的是( )
| A. | 乙烯通入酸性高锰酸钾溶液褪色 | B. | 甲烷在空气中燃烧 | ||
| C. | 钠与酒精混合有气泡 | D. | 苯滴入溴水中振荡后水层接近无色 |
2.下列叙述正确的是( )
| A. | 元素的单质一定由氧化或还原该元素的化合物制得 | |
| B. | 一个氧化还原反应中,氧化剂和还原剂一定是两种不同的物质 | |
| C. | 阳离子只能得到电子被还原,阴离子只能失去电子被氧化 | |
| D. | 含有最高价元素的化合物不一定具有很强的氧化性 |
3.18克葡萄糖(C6H12O6)与32克氧气充分反应生成二氧化碳和水蒸气,将生成的气体缓缓通过足量的过氧化钠固体,则固体增重( )克.
| A. | 18 | B. | 16 | C. | 32 | D. | 不能确定 |