题目内容
10.质量相同的O2、NH3、H2、Cl2四种气体中,在相同温度和相同压强条件下,体积最大的是H2.分析 根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$可知,相同质量时气体的摩尔质量越大,物质的量越小;在相同温度和相同压强条件下,气体的体积越小,据此进行解答.
解答 解:根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$可知,相同质量时,气体的摩尔质量越大,物质的量越小,在相同温度和相同压强条件下,气体的体积越小,反之越大,
O2、NH3、H2、Cl2中摩尔质量最小的为H2,则在相同温度和相同压强条件下体积最大的是H2,
故答案为:H2.
点评 本题考查物质的量的计算,题目难度不大,明确物质的量与莫若质量、气体摩尔体积之间的关系即可解答,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
5.下列说法正确的是( )
| A. | NaCl的摩尔质量是58.5 g/mol | |
| B. | 18gH2O中所含水分子的物质的量是0.5mol | |
| C. | 22gCO2中所含原子数约为3×6.02×1023 | |
| D. | 任何条件下,22.4 L氢气中所含氢分子数都约为6.02×1023 |
1.不同温度下BaCO3在水中的沉淀溶解平衡曲线如图所示(已知T1<T2<T3),下列说法正确的是( )
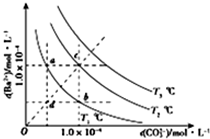

| A. | T2温度下将d点的溶液蒸发浓缩可变为c点 | |
| B. | a点的Ksp小于B点的Ksp | |
| C. | b点溶液中加入BaCl2固体可变为c点 | |
| D. | a点溶液蒸发浓缩恢复到原温度可变为b点 |
18.下列对乙烯和和聚乙烯的描述中,不正确的是( )
| A. | 乙烯是纯净物,聚乙烯是混合物,都能使酸性KMnO4溶液褪色 | |
| B. | 取等质量的乙烯和和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 | |
| C. | 常温下乙烯为气态,聚乙烯为固态 | |
| D. | 乙烯可以发生加成聚合反应生成聚乙烯,聚乙烯的单体是乙烯 |
5.下列变化属于物理变化的是( )
| A. | 乙烯通入酸性高锰酸钾溶液褪色 | B. | 甲烷在空气中燃烧 | ||
| C. | 钠与酒精混合有气泡 | D. | 苯滴入溴水中振荡后水层接近无色 |
15.2015年10月,中国科学家屠呦呦因为创制了新型抗疟药--青蒿素,获得诺贝尔生理学或医学奖.青蒿素可由香茅醛为原料制取,下列说法不正确的是( )
 →
→
 →
→
| A. | 香茅醛能使Br2的CCl4溶液褪色 | |
| B. | 青蒿素分子中含有酯基和醚键等官能团 | |
| C. | 青蒿素在一定条件下可发生水解反应 | |
| D. | 二者均可与氢气发生加成反应 |
2.下列叙述正确的是( )
| A. | 元素的单质一定由氧化或还原该元素的化合物制得 | |
| B. | 一个氧化还原反应中,氧化剂和还原剂一定是两种不同的物质 | |
| C. | 阳离子只能得到电子被还原,阴离子只能失去电子被氧化 | |
| D. | 含有最高价元素的化合物不一定具有很强的氧化性 |
19.下列说法中,正确的是( )
| A. | SO2能使酸性KMnO4溶液褪色,说明SO2具有还原性 | |
| B. | SO2能使品红溶液褪色,其漂白原理与氯水相同 | |
| C. | SO2是酸性氧化物,可以用澄清石灰水来鉴别SO2与CO2 | |
| D. | 用水吸收硫在过量氧气中燃烧的产物,可用于工业制备硫酸 |
 的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
 到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是____________________。
到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是____________________。
