题目内容
17.下列比较正确的是( )| A. | 熔沸点高低:CH4<SiH4<GeH4<SnH4 | |
| B. | 离子半径大小:Cl-<Mg2+<O2-<F- | |
| C. | 分散质微粒直径大小:Fe(OH)3胶体>CaCO3悬浊液>NaCl溶液 | |
| D. | 酸性强弱:H2SO4<H3PO4<H2SiO3 |
分析 A.组成和结构相似的分子,相对分子质量越大,分子间作用力越强,物质的熔沸点越高;
B.电子层越多,离子半径越大,电子层相同时,核电荷数越大离子半径越小;
C.悬浊液中微粒的直径大于胶体粒子的直径;
D.非金属性越强,最高价氧化物对应的水合物的酸性越强.
解答 解:A.CH4、SiH4、GeH4、SnH4的组成和结构相似,其相对分子质量依次增大,所以熔沸点大小为:CH4<SiH4<GeH4<SnH4,故A正确;
B.Cl-的电子层最多,其离子半径最大,Mg2+、O2-、F-的电子层数相同,核电荷数越大离子半径越小,则离子半径大小为:Mg2+<O2-<F-,正确的离子半径大小为:Mg2+<O2-<F-<Cl-,故B错误;
C.分散质微粒中,悬浊液的粒子直径最大,其次为胶体,溶液最小,所以分散质微粒直径大小为:CaCO3悬浊液>Fe(OH)3胶体>NaCl溶液,故C错误;
D.非金属性:S>P>Si,则最高价含氧酸的酸性强弱为:H2SO4>H3PO4>H2SiO3,故D错误;
故选A.
点评 本题考查了原子结构与元素周期律的关系、分散系分类及性质,题目难度不大,明确元素周期律内容为解答关键,注意掌握分散系的分类依据,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
8.如图所示装置中图1灯泡不亮,图2灯泡发亮,由此得出的结论是( )


| A. | NaCl溶液能导电,是电解质 | |
| B. | 电解质在电流的作用下才能发生电离 | |
| C. | 水是电解质,能产生大量的H+和OH- | |
| D. | NaCl溶液中存在大量自由移动的Na+和Cl- |
5.下列说法正确的是( )
| A. | NaCl的摩尔质量是58.5 g/mol | |
| B. | 18gH2O中所含水分子的物质的量是0.5mol | |
| C. | 22gCO2中所含原子数约为3×6.02×1023 | |
| D. | 任何条件下,22.4 L氢气中所含氢分子数都约为6.02×1023 |
2.设NA代表阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 20gD2O含电子数目为10NA | |
| B. | 标准状态下84gC3H6中含碳碳双键的数目为2NA | |
| C. | 1 L 0.1 mol/L NH4NO3溶液中含铵根离子数目小于0.1NA | |
| D. | 标准状态下44.8LCl2与足量水反应转移的电子数目一定小于2NA |
9.有一系列有机物分子,每个碳原子与周围3个碳原子形成碳碳单键,碳原子剩余价键被氢原子饱和.其中甲、乙、丙三种有机物结构如图所示,下列关于它们的描述正确的是( )

| A. | 甲、乙、丙组成结构相似,互为同系物 | |
| B. | 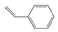 是丙的同分异构体 是丙的同分异构体 | |
| C. | 乙的二氯代物有4种 | |
| D. | 甲、乙、丙均为不饱和烃,它们都能使溴的CCl4溶液褪色 |
1.不同温度下BaCO3在水中的沉淀溶解平衡曲线如图所示(已知T1<T2<T3),下列说法正确的是( )
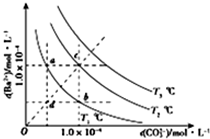

| A. | T2温度下将d点的溶液蒸发浓缩可变为c点 | |
| B. | a点的Ksp小于B点的Ksp | |
| C. | b点溶液中加入BaCl2固体可变为c点 | |
| D. | a点溶液蒸发浓缩恢复到原温度可变为b点 |
2.下列叙述正确的是( )
| A. | 元素的单质一定由氧化或还原该元素的化合物制得 | |
| B. | 一个氧化还原反应中,氧化剂和还原剂一定是两种不同的物质 | |
| C. | 阳离子只能得到电子被还原,阴离子只能失去电子被氧化 | |
| D. | 含有最高价元素的化合物不一定具有很强的氧化性 |
 .
.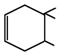 .
.