题目内容
II.(物质结构题)下表为长式周期表的一部分,其中的字母代表相应的元素
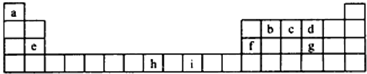
试回答下列问题:
(1)a分别与g、d形成的化合物中沸点较高的是 (填化学式).
该分子中d原子的杂化方式为 .
(2)c、d、e、f元素的第一电离能(I1)由小到大的顺序为 (元素符号表示).
(3)由表中元素形成的一种离子与单质d3互为等电子体,其化学式为 .
(4)元素h的二价阳离子的基态电子排布式为 .

试回答下列问题:
(1)a分别与g、d形成的化合物中沸点较高的是
该分子中d原子的杂化方式为
(2)c、d、e、f元素的第一电离能(I1)由小到大的顺序为
(3)由表中元素形成的一种离子与单质d3互为等电子体,其化学式为
(4)元素h的二价阳离子的基态电子排布式为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知a为H、b为C、c为N、d为O、e为Mg、f为Al、g为S、h为Fe、i为Ni.
(1)水分子之间存在氢键,沸点高于硫化氢;计算O原子价层电子对数,确定杂化方式;
(2)非金属元素第一电离能高于金属元素,N元素原子2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,Mg元素原子3s能级容纳2个电子,处于全满稳定状态,能量较低,第一电离能高于同周期相邻元素;
(3)原子总数相等、价电子总数(或电子总数)相等的微粒互为等电子体;
(4)Fe元素原子失去4s能级2个电子形成Fe2+.
(1)水分子之间存在氢键,沸点高于硫化氢;计算O原子价层电子对数,确定杂化方式;
(2)非金属元素第一电离能高于金属元素,N元素原子2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,Mg元素原子3s能级容纳2个电子,处于全满稳定状态,能量较低,第一电离能高于同周期相邻元素;
(3)原子总数相等、价电子总数(或电子总数)相等的微粒互为等电子体;
(4)Fe元素原子失去4s能级2个电子形成Fe2+.
解答:
解:由元素在周期表中位置,可知a为H、b为C、c为N、d为O、e为Mg、f为Al、g为S、h为Fe、i为Ni.
(1)水分子之间存在氢键,常温下,水为液态,而硫化氢为气体,故水的沸点高于硫化氢;水分子中O原子价层电子对数=2+
=4,故O原子采取sp3杂化方式,故答案为:H2O;sp3;
(2)非金属元素第一电离能高于金属元素,N元素原子2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,Mg元素原子3s能级容纳2个电子,处于全满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:Al<Mg<O<N,故答案为:Al<Mg<O<N;
(3)由表中元素形成的一种离子与单质O3互为等电子体,其化学式为NO2-,故答案为:NO2-;
(4)Fe元素原子失去4s能级2个电子形成Fe2+,Fe2+基态电子排布式为3d6,故答案为:3d6.
(1)水分子之间存在氢键,常温下,水为液态,而硫化氢为气体,故水的沸点高于硫化氢;水分子中O原子价层电子对数=2+
| 6-1×2 |
| 2 |
(2)非金属元素第一电离能高于金属元素,N元素原子2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,Mg元素原子3s能级容纳2个电子,处于全满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:Al<Mg<O<N,故答案为:Al<Mg<O<N;
(3)由表中元素形成的一种离子与单质O3互为等电子体,其化学式为NO2-,故答案为:NO2-;
(4)Fe元素原子失去4s能级2个电子形成Fe2+,Fe2+基态电子排布式为3d6,故答案为:3d6.
点评:本题是对物质结构的考查,涉及杂化轨道、电离能、等电子体、核外电子排布、氢键等,注重主干知识的考查,注意理解掌握同周期元素第一电离能特殊性,难度不大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
下列反应的离子方程式正确的是( )
| A、醋酸与锌粒反应:2H++Zn=H2↑+Zn2+ | ||||
| B、用FeCl3溶液腐蚀铜板:Cu+Fe3+=Cu2++Fe2+ | ||||
| C、向CaCl2溶液中通入少量CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+ | ||||
D、用石墨电极电解食盐水:2Cl-+2H2O
|
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同.下列分析正确的是( )
| A、脱氧过程是吸热反应,可降低温度,延长糕点保质期 |
| B、含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
| C、脱氧过程中铁作原电池负极,电极反应为:Fe-3e-=Fe3+ |
| D、脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e-=4OH- |

