题目内容
现有下列短周期元素性质的一部分数据,请按要求回答下列问题
(1)用元素符号标出Q、R在周期表中对应的位置.
(2)在上面的元素周期表中标出通常寻找催化剂以及耐高温、耐腐蚀的合金材料的区域,用斜线阴影标明.
(3)①L、M、Q所代表元素的离子半径最大的是 (填离子符号).
②L、M、T单质熔点最低的是 (填单质化学式)
③M、L 单质中金属性较强的物质是 (填名称),可验证该结论的实验是
A.将在空气中放置已久的这两种元素的块状单质分别放入热水中
B.将这两种元素的单质粉末分别与盐酸反应
C.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
D.比较两种元素的最高价氧化物对应水化物的碱性强弱
E.M棒和L棒插入稀硫酸溶液中组成原电池,作负极的金属性强
(4)周期表中某些元素有“对角线相似”现象(即周期表中处于对角线位置的两元素性质相似,如Li 和Mg、B和Si 两两性质相似).写出R单质与氢氧化钾溶液反应的化学方程式 .
| 元素代号 | L | M | Q | R | T | |
| 原子半径(10-10 m) | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | |
| 常见化合价 | 最高正价 | +2 | +3 | +6 | +2 | |
| 最低负价 | -2 | -2 | ||||
(3)①L、M、Q所代表元素的离子半径最大的是
②L、M、T单质熔点最低的是
③M、L 单质中金属性较强的物质是
A.将在空气中放置已久的这两种元素的块状单质分别放入热水中
B.将这两种元素的单质粉末分别与盐酸反应
C.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
D.比较两种元素的最高价氧化物对应水化物的碱性强弱
E.M棒和L棒插入稀硫酸溶液中组成原电池,作负极的金属性强
(4)周期表中某些元素有“对角线相似”现象(即周期表中处于对角线位置的两元素性质相似,如Li 和Mg、B和Si 两两性质相似).写出R单质与氢氧化钾溶液反应的化学方程式
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:Q、T都最低价-2,且Q有+6价,原子半径较大,故Q为S元素、T为O元素;L、R都有最高价+2,处于ⅡA族,且原子半径L>R,故L为Mg、R为Be;M有最高价+3,处于ⅢA族,原子半径大于S,故M为Al.
(1)Be处于第二周期ⅡA族,S处于第三周期ⅥA族;
(2)通常在过渡元素中寻找寻找催化剂以及耐高温、耐腐蚀的合金材料;
(3)①电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
②根据通常情况下物质的状态判断熔点;
③同周期自左而右金属性减弱,可以根据金属与水或酸反应难易、剧烈程度判断,根据最高价氧化物对应水化物的碱性、单质之间的置换,电化学原理等判断;
(4)Be与Al的性质相似,Be与氢氧化钾溶液反应生成K2BeO2与氢气.
(1)Be处于第二周期ⅡA族,S处于第三周期ⅥA族;
(2)通常在过渡元素中寻找寻找催化剂以及耐高温、耐腐蚀的合金材料;
(3)①电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
②根据通常情况下物质的状态判断熔点;
③同周期自左而右金属性减弱,可以根据金属与水或酸反应难易、剧烈程度判断,根据最高价氧化物对应水化物的碱性、单质之间的置换,电化学原理等判断;
(4)Be与Al的性质相似,Be与氢氧化钾溶液反应生成K2BeO2与氢气.
解答:
解:Q、T都最低价-2,且Q有+6价,原子半径较大,故Q为S元素、T为O元素;L、R都有最高价+2,处于ⅡA族,且原子半径L>R,故L为Mg、R为Be;M有最高价+3,处于ⅢA族,原子半径大于S,故M为Al.
(1)Be处于第二周期ⅡA族,S处于第三周期ⅥA族;
(2)通常在过渡元素中寻找寻找催化剂以及耐高温、耐腐蚀的合金材料,
(1)(2)标出在周期表中的位置为: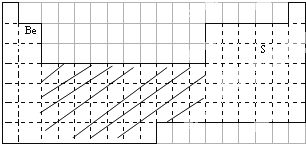 ,
,
故答案为: ;
;
(3)①电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->Mg2+>Al3+,故答案为:S2-;
②通常情况下,Mg、Al为固体,而氧气为气体,故氧气的熔点最低,故答案为:O2;
③同周期自左而右金属性减弱,故金属性Mg>Al,
A.将在空气中放置已久的这两种元素的块状单质,表面生成氧化物保护膜,阻止内部金属与水的反应,故A错误;
B.将这两种元素的单质粉末分别与盐酸反应,反应都非常激烈,难以判断金属性强弱,故B错误;
C.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液,根据溶液碱性强弱判断,故C正确;
D.元素的最高价氧化物对应水化物的碱性越强,对应元素的金属性越强,故D正确;
E.M棒和L棒插入稀硫酸溶液中组成原电池,作负极的金属性强,说明M的金属性更强,故E正确,
故答案为:镁;CDE;
(4)Be与Al的性质相似,Be与氢氧化钠溶液反应生成Na2BeO2与氢气,反应离子方程式为:Be+2KOH=K2BeO2+H2↑,故答案为:Be+2KOH=K2BeO2+H2↑.
(1)Be处于第二周期ⅡA族,S处于第三周期ⅥA族;
(2)通常在过渡元素中寻找寻找催化剂以及耐高温、耐腐蚀的合金材料,
(1)(2)标出在周期表中的位置为:
 ,
,故答案为:
 ;
;(3)①电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->Mg2+>Al3+,故答案为:S2-;
②通常情况下,Mg、Al为固体,而氧气为气体,故氧气的熔点最低,故答案为:O2;
③同周期自左而右金属性减弱,故金属性Mg>Al,
A.将在空气中放置已久的这两种元素的块状单质,表面生成氧化物保护膜,阻止内部金属与水的反应,故A错误;
B.将这两种元素的单质粉末分别与盐酸反应,反应都非常激烈,难以判断金属性强弱,故B错误;
C.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液,根据溶液碱性强弱判断,故C正确;
D.元素的最高价氧化物对应水化物的碱性越强,对应元素的金属性越强,故D正确;
E.M棒和L棒插入稀硫酸溶液中组成原电池,作负极的金属性强,说明M的金属性更强,故E正确,
故答案为:镁;CDE;
(4)Be与Al的性质相似,Be与氢氧化钠溶液反应生成Na2BeO2与氢气,反应离子方程式为:Be+2KOH=K2BeO2+H2↑,故答案为:Be+2KOH=K2BeO2+H2↑.
点评:本题考查元素周期表与元素周期律综合应用,难度中等,注意金属性、非金属性强弱比较及实验事实,(3)③中B选项为易错点,学生忽略Mg、Al都是粉末状,与盐酸反应都非常激烈,难以判断.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
下列实验操作中错误的是( )
| A、在由氢氧化铜分解制氧化铜时,要边加热边用玻璃棒搅拌 |
| B、用药匙或者纸槽把粉末状药品送入试管的底部 |
| C、过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 |
| D、刚完成蒸发结晶,因要做下一个实验,可以将蒸发皿先放在桌面上,冷却后收好 |
下列说法正确的是( )
| A、常温下pH为5的盐酸溶液稀释1000倍后,pH等于8 |
| B、浓度均为0.1mol/L的氨水和氯化铵溶液,水电离出的c(H+)前者小于后者 |
| C、碳酸钠溶液中存在:c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) |
| D、等浓度的CH3COOH与KOH以任意比混合:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
下列溶液中物质的量浓度肯定为1mol/L的是( )
| A、将40g NaOH固体溶解于1L水中 |
| B、将22.4L氯化氢气体溶于水配成1L溶液 |
| C、将1L 10 mol/L浓盐酸与10L水混合 |
| D、10g NaOH固体溶解在水中配成250mL溶液 |
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图: