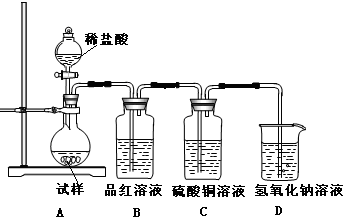
题目内容
2.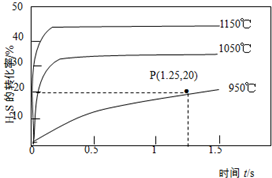 硫化氢分解制取氢气和硫磺的原理为:2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )
硫化氢分解制取氢气和硫磺的原理为:2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,不同温度下测得H2S的转化率与时间的关系如图所示.下列说法正确的是( )| A. | 图中P点:v(正)>v(逆) | |
| B. | 正反应为放热反应 | |
| C. | 950℃时,0~1.25s生成H2的平均反应速率为:0.008mol•L-1•s-1 | |
| D. | 950℃时,该反应的平衡常数的值小于3.125×10-4 |
分析 A、图中P点未达平衡状态,在这种状态下最终达平衡状态,硫化氢的转化率变大;
B、升高温度,硫化氢的转化率变大,说明平衡正向移动;
C、H2的平均反应速率为:v=$\frac{△c}{△t}$;
D、Qc=$\frac{0.0{1}^{2}×0.05}{0.0{4}^{2}}$=3.125×10-4,而反应正向移动,所以平衡常数的值大于3.125×10-4.
解答 解:A、图中P点未达平衡状态,在这种状态下最终达平衡状态,硫化氢的转化率变大,反应向正反应方向进行,所以v(正)>v(逆),故A正确;
B、升高温度,硫化氢的转化率变大,说明平衡正向移动,正反应方向是吸热反应,故B错误;
C、2H2S(g)?S2(g)+2H2(g),在2.0L恒容密闭容器中充入0.1molH2S,此时硫化氢的转化率为:20%,则氢气的变化量为:0.1×0.2=0.02mol,所以v(H2)=$\frac{\frac{0.02mol}{2L}}{1.25s}$=0.008mol•L-1•s-1,故C正确;
D、Qc=$\frac{0.0{1}^{2}×0.05}{0.0{4}^{2}}$=3.125×10-4,而反应正向移动,所以平衡常数的值大于3.125×10-4,故D错误;
故选AC.
点评 本题考查化学平衡的计算等知识,题目难度中等,注意掌握化学反应速率、明确反应进行的方向,是解题的关键.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
12.下表列出了①~⑨九种元素在周期表中的位置:
请按要求回答下列问题.
(1)化学性质最不活泼的元素的原子结构示意图为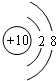
(2)⑥④⑦的氢化物的稳定性最强的是:H2O(写氢化物的化学式);
(3)元素③④⑤形成的离子半径由大到小的顺序是N3->O2->Na+(用离子符号表示)
(4)用电子式表示元素⑤与⑦的化合物的形成过程: .
.
| ⅠA | Ⅷ | ||||||
| ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| ② | ③ | ④ | ⑧ | ||||
| ⑤ | ⑥ | ⑦ | ⑨ | ||||
(1)化学性质最不活泼的元素的原子结构示意图为
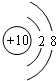
(2)⑥④⑦的氢化物的稳定性最强的是:H2O(写氢化物的化学式);
(3)元素③④⑤形成的离子半径由大到小的顺序是N3->O2->Na+(用离子符号表示)
(4)用电子式表示元素⑤与⑦的化合物的形成过程:
 .
.
13.用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1mol 的CuO和0.1molH2O后恰好恢复到电解前的浓度,则电解过程中阳极产生的气体在标准状况下的体积为( )
| A. | 2.24L | B. | 3.36L | C. | 1.12L | D. | 4.48L |
17.下列表示对应化学反应的离子方程式正确的是( )
| A. | 加入NaClO将污水中的NH3氧化成N2:3ClO-+2NH3═N2↑+3Cl-+3H2O | |
| B. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| C. | NaAlO2溶液中AlO2-的水解:AlO2-+2H2O═Al(OH)3↓+OH- | |
| D. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- |
7.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲?乙?丙?戊是由其中的两种或三种元素组成的化合物,丁是由Z元素形成的单质.已知:甲+丙→丁+己,甲+乙→戊+丁;25℃时0.01mol•L-1己溶液的pH为12.下列说法不正确的是( )
| A. | 1.0L 0.1mol•L-1戊溶液中阴离子总的物质的量大于0.1mol | |
| B. | 将足量甲加入到酚酞试液中,溶液先变红后褪色 | |
| C. | X与W构成的化合物、戊、己均为离子化合物 | |
| D. | W的简单离子半径大于Z的简单离子半径 |
14.如图所示有机物的一氯取代物有(不含立体异构)( )


| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
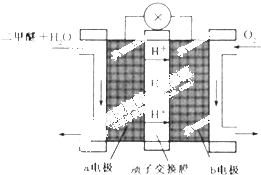 二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应: