题目内容
15.下列物质转化在给定条件下能实现的是( )①S$→_{点燃}^{O_{2}}$SO2$\stackrel{BaCl_{2}(aq)}{→}$BaSO4
②CuSO4(aq)$\stackrel{过量NaOH(aq)}{→}$Cu(OH)2悬浊液$→_{△}^{葡萄糖}$Cu2O
③饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3
④Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3.
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
分析 ①硫单质点燃生成二氧化硫,碳酸酸性弱于亚硫酸,二氧化硫气体入氯化钡溶液中不反应;
②硫酸铜和过量氢氧化钠溶液反应生成氢氧化铜悬浊液,加入葡萄糖加热反应反应氧化反应生成红色沉淀氧化亚铜;
③饱和食盐水中依次通入氨气、二氧化碳会反应生成碳酸氢钠晶体,碳酸氢钠受热分解生成碳酸钠;
④氧化铁和盐酸反应生成氯化铁溶液,加热蒸发促进氯化铁水解正向进行,得到氢氧化铁固体,灼烧分解生成氧化铁.
解答 解:①硫单质点燃生成二氧化硫,S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2,碳酸酸性弱于亚硫酸,二氧化硫气体入氯化钡溶液中不反应,不能生成硫酸钡沉淀,不能实现转化,故①错误;
②硫酸铜和过量氢氧化钠溶液反应生成氢氧化铜悬浊液,加入葡萄糖加热反应,发生氧化反应生成红色沉淀氧化亚铜,检验醛基的存在,过程能实现,故②正确;
③饱和食盐水中依次通入氨气=二氧化碳会反应生成碳酸氢钠晶体,NH3+CO2+NaCl+H2O=NaHCO3↓+NH4Cl,碳酸氢钠受热分解生成碳酸钠,2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2+H2O,能一步实现,故③正确;
④氧化铁和盐酸反应生成氯化铁溶液,氯化铁溶液中水解生成盐酸和氢氧化铁,加热蒸发氯化氢挥发促进氯化铁水解正向进行,得到氢氧化铁固体,灼烧分解生成氧化铁,不能得到无水氯化铁,不能实现转化,故④错误;
故选B.
点评 本题考查了硫、铜、铁及其化合物性质分析,主要是反应产物的判断,注意盐类水解的分析判断,题目难度中等.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
6.下列反应中,生成物的总能量大于反应物总能量的是( )
| A. | 氢气在氧气中燃烧 | B. | 氢气与氯气化合 | ||
| C. | 中和反应 | D. | 焦炭在高温下与水蒸气反应 |
3.生活中遇到的某些问题,常常涉及到化学知识.下列各项叙述不正确的是( )
| A. | 鱼虾放久了会产生不愉快的腥臭气味,应当用水冲洗,并在烹调时加人少量食醋 | |
| B. | “酸可除锈”“洗涤剂可去油”都是发生了化学变化 | |
| C. | 被蜂蚁蜇咬会感到疼痛难忍,这是蜂蚁咬人时将甲酸注人人体的缘故,此时若能涂抹稀氨水或碳酸氢钠溶液,可以减轻疼痛 | |
| D. | 煤酚皂溶液可用于环境消毒,医用酒精可用于皮肤消毒,其原因均在于可以使蛋白质发生变性凝固 |
20.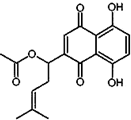 乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法错误的是( )
乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法错误的是( )
 乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法错误的是( )
乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法错误的是( )| A. | 该分子中含有1个手性碳原子 | |
| B. | 能与FeCl3溶液发生显色反应 | |
| C. | 1mol 乙酰紫草素最多可与2molBr2反应 | |
| D. | 1mol乙酰紫草素最多可与2molNaOH反应 |
7.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲?乙?丙?戊是由其中的两种或三种元素组成的化合物,丁是由Z元素形成的单质.已知:甲+丙→丁+己,甲+乙→戊+丁;25℃时0.01mol•L-1己溶液的pH为12.下列说法不正确的是( )
| A. | 1.0L 0.1mol•L-1戊溶液中阴离子总的物质的量大于0.1mol | |
| B. | 将足量甲加入到酚酞试液中,溶液先变红后褪色 | |
| C. | X与W构成的化合物、戊、己均为离子化合物 | |
| D. | W的简单离子半径大于Z的简单离子半径 |
4.龙胆酸甲醋(结构如图所示)是制备抗心律失常药物氟卡尼的中间体.下列有关龙胆酸甲醋的说法.正确的是( )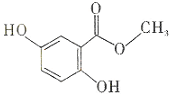

| A. | 分子式为C8H6O4 | B. | 所有的碳原子可能在同一平面内 | ||
| C. | 能发生消去反应 | D. | 能通过加聚反应生成高分子化合物 |
 合成氨工业对工、农业生产和国防都有重要意义.
合成氨工业对工、农业生产和国防都有重要意义. 二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应: