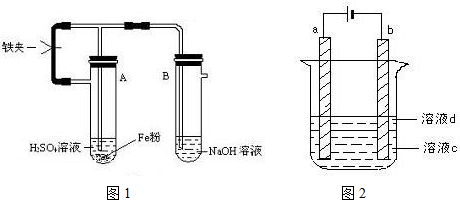
题目内容
15.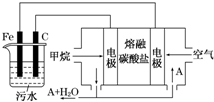 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣.此时,应向污水中加入适量的C.
A.BaSO4 B.CH3CH2OHC.Na2SO4 D.NaOH
(2)电解池阳极发生了两个电极反应,其中一个反应生成一种无色气体,则阳极的电极反应式分别是
Ⅰ.Fe-2e-=Fe2+;
Ⅱ.4OH--4e-═2H2O+O2↑.
(3)电极反应I和Ⅱ的生成物反应得到Fe(OH3)沉淀的离子方程式是4Fe2++10H2O+O2═4Fe(OH)3↓+8H+.
(4)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极.为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图).A物质的化学式是CO2.
分析 (1)从所加入物质能增大溶液离子浓度,并能保持污水的pH在5.0~6.0之间考虑;
(2)根据电极材料和离子的放电顺序考虑;
(3)根据得失电子守恒和电荷守恒即可得离子方程式;
(4)电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳.
解答 解:(1)为了增强溶液的导电性,因此可选用易溶性强电解质溶液,排除A和B,考虑到题中要求电解时保持污水的pH在5.0~6.0之间,因此不能添加NaOH,BaSO4不溶,故答案为:C;
(2)电解时铁作阳极,因此主要发生Fe-2e-=Fe2+,同时也发生副反应,即溶液中的OH-失电子被氧化生成O2,故答案为:Fe-2e-=Fe2+;4OH--4e-═2H2O+O2↑;
(3)根据得失电子守恒和电荷守恒,电极反应I和Ⅱ的生成物反应得到Fe(OH3)沉淀的离子方程式是4Fe2++10H2O+O2═4Fe(OH)3↓+8H+,故答案为:4Fe2++10H2O+O2═4Fe(OH)3↓+8H+;
(4)负极反应是CH4失电子,该电池的电解质环境是熔融碳酸盐,所以负极反应为:CH4+4CO32--8e-=5CO2+2H2O;电池是以熔融碳酸盐为电解质,可以循环利用的物质只有二氧化碳;
故答案为:CO2.
点评 本题考查原电池和电解池的知识,较为综合,做题时注意利用守恒的思考去解答,同时注意电极反应式的书写.

练习册系列答案
相关题目
3.已知某有机物的结构如图所示,下列说法正确的是( )
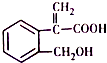

| A. | 分子式为C10H10O3 | |
| B. | 1mol 该有机物最多可与5mol氢气发生加成反应 | |
| C. | 该有机物在一定条件下,可以发生取代、氧化、消去反应 | |
| D. | 1mol 该有机物与足量钠反应生成22.4L氢气(标况下) |
10.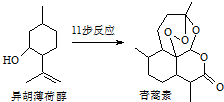 2015年诺贝尔生理学、医学奖的一半授予我国药物化学家屠吆吆,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素.以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年诺贝尔生理学、医学奖的一半授予我国药物化学家屠吆吆,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素.以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图).下列说法正确的是( )
 2015年诺贝尔生理学、医学奖的一半授予我国药物化学家屠吆吆,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素.以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年诺贝尔生理学、医学奖的一半授予我国药物化学家屠吆吆,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素.以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图).下列说法正确的是( )| A. | 异胡薄荷醇的分子式为C10H12O | |
| B. | 青蒿素提取时可以通过加热或加碱溶解的方法提高其浸取率 | |
| C. | 青蒿素易溶于水,而难溶于有机溶剂 | |
| D. | 异胡薄荷醇可发生消去反应 |
4.在强酸性溶液中能够大量共存的离子组是( )
| A. | Na+、Cl-、Al3+、Ag+ | B. | $NH_4^+$、Mg2+、$NO_3^-$、$SO_4^{2-}$ | ||
| C. | K+、Ca2+、$NO_3^-$、$CO_3^{2-}$ | D. | $HCO_3^-$、Na+、K+、$SO_4^{2-}$ |
5.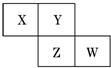 X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
 X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )| A. | X的最常见气态氢化物的水溶液显酸性 | |
| B. | 最高价氧化物对应水化物的酸性W比Z强 | |
| C. | Z的单质与氢气反应比Y单质与氢气反应剧烈 | |
| D. | X的原子半径小于Y |
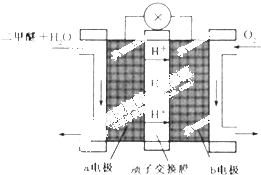 二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应: