题目内容
下列事实可以证明一水合氨是弱电解质的是( )
①0.1mol/L的氨水可使酚酞溶液变红 ②0.1mol/L的氯化铵溶液的pH约为5 ③在相同条件下,氨水的导电性比强碱溶液弱 ④氨水受热分解挥发出氨气 ⑤在氨水中存在NH3?H2O分子.
①0.1mol/L的氨水可使酚酞溶液变红 ②0.1mol/L的氯化铵溶液的pH约为5 ③在相同条件下,氨水的导电性比强碱溶液弱 ④氨水受热分解挥发出氨气 ⑤在氨水中存在NH3?H2O分子.
| A、①② | B、②③⑤ | C、③④ | D、②④ |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:一水合氨是弱电解质,氨水的电离方程式为:NH3?H2O?NH4++OH-证明一水合氨是弱电解质,需证明一水合氨的电离是部分电离;据此分析.
解答:
解:①氨水可以使酚酞试液变红,只说明溶液呈碱性,不能说明NH3?H2O是部分电离还是完全电离,所以不能证明一水合氨是弱电解质,故①错误;
②0.1mol?L-1氯化铵溶液的pH约为5,常温下,任何浓度的强酸强碱盐的pH应为7,而0.1mol?L-1氯化铵溶液的pH约为5,说明NH4Cl为强酸弱碱盐,即一水合氨是弱碱,可证明一水合氨是弱电解质,故②正确;
③在相同条件下,氨水溶液的导电性比强碱溶液弱,说明氨水溶液中电离出来的离子浓度比强电解质小,即一水合氨部分电离是弱电解质,故③正确;
④氨水受热分解挥发出氨气,与氨水是弱碱,无因果关系,不能证明氨水是弱碱,故④错误;
⑤在氨水中存在NH3?H2O分子,说明NH3?H2O没有完全电离,即NH3?H2O是弱电解质,故⑤正确;
所以正确的有②③⑤;
故选B.
②0.1mol?L-1氯化铵溶液的pH约为5,常温下,任何浓度的强酸强碱盐的pH应为7,而0.1mol?L-1氯化铵溶液的pH约为5,说明NH4Cl为强酸弱碱盐,即一水合氨是弱碱,可证明一水合氨是弱电解质,故②正确;
③在相同条件下,氨水溶液的导电性比强碱溶液弱,说明氨水溶液中电离出来的离子浓度比强电解质小,即一水合氨部分电离是弱电解质,故③正确;
④氨水受热分解挥发出氨气,与氨水是弱碱,无因果关系,不能证明氨水是弱碱,故④错误;
⑤在氨水中存在NH3?H2O分子,说明NH3?H2O没有完全电离,即NH3?H2O是弱电解质,故⑤正确;
所以正确的有②③⑤;
故选B.
点评:本题考查了弱电解质的判断,注意对概念的把握,在溶液中部分电离的电解质为弱电解质,题目难度不大.

练习册系列答案
相关题目
在下列各物质中,所含分子数相同的是( )
| A、1gH2和16gO2 |
| B、9gH2O和1molBr2 |
| C、11.2LN2(标况)和11gCO2(标况) |
| D、2.24LH2(标况)和2.24LH2O(标况) |
下列关于浓硫酸的叙述中,正确的是( )
| A、常温时,可与Al反应生成大量H2 |
| B、将浓硫酸置于敞口容器中,经过一段时间质量将减少 |
| C、稀释浓硫酸时,应将其沿着器壁慢慢加入到水中,并用玻璃棒不断搅拌 |
| D、硫酸是强酸,所以通常用浓硫酸与大理石反应制取二氧化碳 |
下列对电离平衡常数K的叙述中,不正确的是( )
| A、与溶液的物质的量浓度有关 |
| B、只与温度有关,而与浓度无关 |
| C、根据相同条件下K的大小,可以判断弱酸的相对强弱 |
| D、升高温度K增大 |
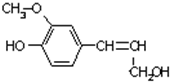 木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如图所示.下列说法错误的是( )
木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如图所示.下列说法错误的是( )| A、该物质的分子式是C10H12O3,属于芳香烃 |
| B、该物质可以与FeCl3溶液发生显色反应,也能发生酯化反应 |
| C、1mol该物质最多能消耗4mol H2 |
| D、1mol该物质与溴水发生反应,可消耗4mol Br2 |
 已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的.
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的.