题目内容
20.SnS04是一种重要的硫酸盐,在工业生产中有着广泛的应用.其制备路线如图:
已知:在酸性条件下,溶液中的Sn2+可被空气中的氧气氧化成Sn4+; SnCl2能水解生成碱式氯化亚锡.
(1)写出物质A的名称:硫酸.
(2)SnCl2用盐酸而不用水溶解的原因是SnCl2+H2O?Sn(OH)Cl+HCl
(3)锡粉的作用是除去酸溶时产生的少量Sn4+,请写出产生Sn4+的离子方程式:2Sn2++O2+4H+═2Sn4++2H2O.
(4)反应I生成的沉淀为SnO,写出该反应的化学方程式:SnCl2+2NH4HCO3═SnO↓+2CO2↑+2NH4Cl+H2O
(5)实验室中“漂洗”沉淀的实验操作方法是(沿玻璃棒)向漏斗(或过滤器)中加蒸馏水至浸没沉淀,(静置)待水全部流出后,重复操作2~3次.
分析 SnCl2先用盐酸溶解,后又加了锡粉主要是防止在溶解时水解和被空气中氧气氧化,在过滤出锡粉,得到SnCl2溶液在反应Ⅰ与碳酸氢铵反应生成SnO、氯化铵、二氧化碳和水,再过滤得到SnO沉淀,经过漂洗除去表面的杂质离子,再在反应Ⅱ中与硫酸反应生成SnSO4,进一步提炼最终得到SnSO4晶体,据此分析;
(1)根据(4)反应Ⅰ生成的沉淀为SnO结合最终生成SnSO4来分析;
(2)SnCl2易水解生成碱式氯化亚锡,加入盐酸,抑制Sn2+水解;
(3)酸性条件下,SnCl2可以被空气中的氧气氧化,将Sn2+氧化为Sn4+,自身被还原为水;
(4)反应Ⅰ得到沉淀是SnO,Sn元素化合价没有变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳;
(5)(沿玻璃棒)向漏斗(或过滤器)中加蒸馏水至浸没沉淀,(静置)待水全部流出后,重复操作2~3次.
解答 解:(1)由(4)反应Ⅰ生成的沉淀为SnO,所以反应Ⅱ即SnO与A反应生成SnSO4,故A为硫酸,故答案为:硫酸;
(2)SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;故答案是:SnCl2+H2O?Sn(OH)Cl+HCl;
(3)酸性条件下,SnCl2可以被空气中的氧气氧化,将Sn2+氧化为Sn4+,自身被还原为水,离子方程式为:2Sn2++O2+4H+═2Sn4++2H2O,
故答案为:2Sn2++O2+4H+═2Sn4++2H2O;
(4)反应Ⅰ得到沉淀是SnO,Sn元素化合价没有变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,化学方程式为:SnCl2+2NH4HCO3═SnO↓+2CO2↑+2NH4Cl+H2O,故答案为:SnCl2+2NH4HCO3═SnO↓+2CO2↑+2NH4Cl+H2O;
(5)“漂洗”的方法是:(沿玻璃棒)向漏斗(或过滤器)中加蒸馏水至浸没沉淀,(静置)待水全部流出后,重复操作2~3次;故答案为:(沿玻璃棒)向漏斗(或过滤器)中加蒸馏水至浸没沉淀,(静置)待水全部流出后,重复操作2~3次.
点评 本题SnSO4制备的之比为载体,考查学生对工艺流程的理解、物质的分离提纯、阅读题目获取信息的能力、常用化学用语书写及利用关系式进行的计算等,难度中等,对学生的基础知识及逻辑推理有较高的要求.

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案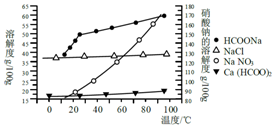 甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.Ⅰ.实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑.
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30~70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是使甲醛充分氧化,提高甲醛的利用率和产品纯度.
(2)反应温度最好控制在30~70℃之间,温度不易过高,其主要原因是防止H2O2分解和甲醛挥发 .
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是除去重金属离子.
(4)实验时需强力搅拌45min,其目的是使反应物充分接触,提高产率;结束后需调节溶液的pH 7~8,其目的是防止甲酸钙水解.最后经结晶分离、干燥得产品.
Ⅱ.某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合下图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算),现提供的试剂有:a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水.
| 金属 离子 | 开始沉淀 的pH | 沉淀完全 的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
步骤1:称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用.
步骤2:用稍过量硝酸溶解碳酸钙样品.
步骤3:用石灰水调整溶液pH=5.
步骤4:过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、趁热过滤、洗涤、60℃时干燥得甲酸钙晶体.
①2Fe3++H2O2═2Fe2++O2↑+2H+②2Fe2++H2O2+2H+═2Fe3++2H2O
下列说法不正确的是( )
| A. | Fe3+在反应①中作氧化剂,在反应②中为氧化产物 | |
| B. | 若生成标准状况下22.4 L O2,则整个过程中转移电子总数为2 mol | |
| C. | 在H2O2分解过程中,溶液的pH逐渐减小 | |
| D. | 在工业生产H2O2过程中要严格避免混入Fe3+ |
| A. | “滴水石穿、绳锯木断”不涉及化学变化 | |
| B. | 氟利昂作制冷剂会加剧雾霾天气的形成 | |
| C. | 明矾净水的原理和“84”消毒液消毒的原理不相同 | |
| D. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 |
| A. | 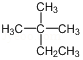 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 | |
| B. | 用酸性KMnO4溶液可以确定CH2=CH-CHO中含有C=C双键 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 在一定条件下,乙酸、氨基乙酸、蛋白质均能与NaOH发生反应 |
| A. | 烟花燃放,五彩缤纷的焰火体现了某些金属元素的物理性质 | |
| B. | “雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 | |
| C. | 淀粉和纤维素都能水解,水解最终产物都为葡萄糖 | |
| D. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 |
| A. | 36g镁在足量的氮气中完全燃烧共转移的电子数为3NA | |
| B. | 室温下,21.0g乙烯和丁烯的混合气体中含有的C-H共价键数目为3NA | |
| C. | 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA | |
| D. | 1 molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32-一定存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |