题目内容
6.下列说法正确的是( )| A. | 外加直流电源保护钢闸门时,钢闸门与电源的负极相连 | |
| B. | 铅蓄电池在放电过程中,负极质量增加,正极质量减少 | |
| C. | 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,K值及SO2转化率不变 |
分析 A、金属的腐蚀与防护中如果有外接电源,此方法为外加电源的阴极保护法;
B、铅蓄电池工作时,负极是金属铅失电子,正极上是二氧化铅得电子,都是生成硫酸铅;
C、CaCO3的溶解度小于CaSO4,根据沉淀的转化来分析;
D、根据影响化学平衡移动的因素来回答.
解答 解:A、将钢闸门与外加电源负极相连,阴极上电解质溶液中阳离子得电子发生还原反应,此方法为外加电源的阴极保护法,可防止钢闸门腐蚀,故A正确;
B、铅蓄电池工作时,负极是金属铅失电子,正极上是二氧化铅得电子,都是生成硫酸铅,质量增加,故B错误;
C、CaCO3的溶解度小于CaSO4,故CaSO4用饱和Na2CO3溶液浸泡可转化为溶解度更小的CaCO3,然后再用稀盐酸溶解除去,故C正确;
D、t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,K值不变但是氧气会和NO反应,化学平衡正向移动,所以SO2转化率增大,故D错误.
故选AC.
点评 本题综合考查电化学金属的腐蚀和防护以及化学平衡移动原理知识,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
17.工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应.现将2molSO2和1molO2充入一密闭容器充分反应后,放出热量a KJ,此时测得SO2的转化率为50%,则下列热化学方程式中正确的是( )
| A. | 2SO2(g)+O2(g)?2SO3(g);△H=-2a KJ/mol | B. | 2SO2(g)+O2(g)2?SO3(g);△H=-a KJ/mol | ||
| C. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=a KJ/mol | D. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-2a KJ/mol |
1.短周期主族元素X、Y、Z、M、N的原子序数依次增大.X和M的原子核外均有两个未成对电子,但不处于同一主族.Y、Z、M最高价氧化物对应的水化物两两之间能相互反应.下列叙述正确的是( )
| A. | 原子半径:r(Z)>r(Y)>r(M) | |
| B. | Y和M形成的化合物只含有离子键 | |
| C. | 元素非金属性由弱到强的顺序:M、N、X | |
| D. | 电解N和Z形成的化合物可得到Z的单质 |
11. 甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.
Ⅰ.实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑.
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30~70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是使甲醛充分氧化,提高甲醛的利用率和产品纯度.
(2)反应温度最好控制在30~70℃之间,温度不易过高,其主要原因是防止H2O2分解和甲醛挥发 .
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是除去重金属离子.
(4)实验时需强力搅拌45min,其目的是使反应物充分接触,提高产率;结束后需调节溶液的pH 7~8,其目的是防止甲酸钙水解.最后经结晶分离、干燥得产品.
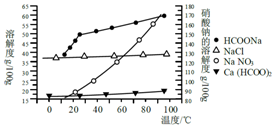
Ⅱ.某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合下图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算),现提供的试剂有:a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水.
实验步骤
步骤1:称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用.
步骤2:用稍过量硝酸溶解碳酸钙样品.
步骤3:用石灰水调整溶液pH=5.
步骤4:过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、趁热过滤、洗涤、60℃时干燥得甲酸钙晶体.
 甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.
甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.Ⅰ.实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑.
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30~70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是使甲醛充分氧化,提高甲醛的利用率和产品纯度.
(2)反应温度最好控制在30~70℃之间,温度不易过高,其主要原因是防止H2O2分解和甲醛挥发 .
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是除去重金属离子.
(4)实验时需强力搅拌45min,其目的是使反应物充分接触,提高产率;结束后需调节溶液的pH 7~8,其目的是防止甲酸钙水解.最后经结晶分离、干燥得产品.
Ⅱ.某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合下图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算),现提供的试剂有:a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水.
| 金属 离子 | 开始沉淀 的pH | 沉淀完全 的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
步骤1:称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用.
步骤2:用稍过量硝酸溶解碳酸钙样品.
步骤3:用石灰水调整溶液pH=5.
步骤4:过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、趁热过滤、洗涤、60℃时干燥得甲酸钙晶体.
18.0.1molCu、0.lmolH2SO4、0.1lmolHNO3混合共1L,充分反应,下列预测正确的是( )
| A. | 铜全部溶解,且溶液为蓝色,有红棕色气体产生 | |
| B. | 铜部分溶解,且溶液为蓝色,有红棕色气体产生 | |
| C. | 铜全部溶解,且溶液为蓝色,有无色气体产生 | |
| D. | 铜部分溶解,且溶液为蓝色,有无色气体产生 |
15.化学与生产、生活、环境等社会实际密切相关.下列叙述正确的是( )
| A. | “滴水石穿、绳锯木断”不涉及化学变化 | |
| B. | 氟利昂作制冷剂会加剧雾霾天气的形成 | |
| C. | 明矾净水的原理和“84”消毒液消毒的原理不相同 | |
| D. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 |
16.下列叙述正确的是( )
| A. | NH4Cl是电解质,所以NH4Cl溶液是电解质 | |
| B. | Al2O3是两性氧化物,所以它能溶解于盐酸也能溶于氨水中 | |
| C. | 用FeCl3溶液制作印刷电路板的原因是Fe3+具有氧化性 | |
| D. | Fe(OH)3胶体的本质特征是能产生丁达尔效应 |
 1,3-丁二烯(CH2=CHCH=CH2)和2-丁炔(CH3C CH3)是重要的有机原料.
1,3-丁二烯(CH2=CHCH=CH2)和2-丁炔(CH3C CH3)是重要的有机原料.