题目内容
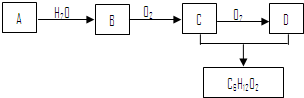
19. 元素在周期表中的位置,反映了元素的原子结构和元素性质.图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素性质.图是元素周期表的一部分.(1)阴影部分中元素N在元素周期表中的位置为第二周期VA族,其单质分子中含有的共用电子对数目为3对.
(2)根据元素周期律,请你预测H3AsO4、H3PO4的酸性强弱:H3AsO4<H3PO4(填“>”、“<”或“=”).
(3)在一定条件下,S、Se都能与H2反应,根据元素周期律判断,Se与H2反应比S与H2的反应更难.(填“更难”或“更易”)
分析 (1)由图可知,N位于第二周期第VA族,单质的结构式为N≡N;
(2)非金属性越强,对应最高价含氧酸的酸性越强;
(3)非金属性越强,越易与氢气化合.
解答 解:(1)由图可知,N位于第二周期第VA族,单质的结构式为N≡N,则单质分子中含有的共用电子对数目为3对,故答案为:二;VA;3;
(2)非金属性P>As,对应最高价含氧酸的酸性H3AsO4<H3PO4,故答案为:<;
(3)非金属性Se<S,Se与H2反应比S与H2的反应更难,故答案为:更难.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+28HNO3=9Fe(NO3)x+NO↑+14H2O,下列判断合理的是( )
| A. | Fe(NO3)x中的x为2 | |
| B. | 稀HNO3在反应中只表现氧化性 | |
| C. | 反应中每还原0.4 mol氧化剂,就有1.2 mol电子被转移 | |
| D. | 磁性氧化铁中的铁元素全部被氧化 |
10.下列关于实验原理或操作的叙述中,不正确的是( )
| A. | 纸层析实验中,须将滤纸上的试样点浸入展开剂中 | |
| B. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度不一定要比水大 | |
| C. | 从碘水中提取单质碘时,不能用无水乙醇代替CCl4 | |
| D. | 分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 |
7.下列各组物质之间的化学反应,所得的有机产物一定为纯净物的是( )
| A. | 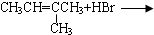 | B. | CH3CH2OH+O2$→_{△}^{Cu}$ | ||
| C. | CH4+Cl2 $\stackrel{光照}{→}$ | D. | nCH2=CH2$→_{△}^{催化剂}$ |
14.下列说法错误的是( )
| A. | 工业上电解熔融状态的Al2O3制备Al涉及氧化还原反应 | |
| B. | 四川灾区重建使用了大量钢材,钢材是合金 | |
| C. | 金属材料都是导体,非金属材料都是绝缘体 | |
| D. | 合金材料中可能含有非金属元素 |
11.二战期间,有支侦查小分队去炸毁德国法西斯的一座隐蔽且戒备森严的军火工厂,结果他们用十多只涂有化学药剂的老鼠完成了任务.据你推测这种化学药剂可能是( )
| A. | TNT | B. | 白磷的CS2溶液 | C. | 黑火药和甘油 | D. | KMnO4和H2SO4 |
8.下列叙述不正确的是( )
| A. | 0.1mol Fe和0.1mol Zn被氧化,共转移电子0.2mol | |
| B. | 标准状况下,22.4L N2和N2O4的混合物,含N原子2mol | |
| C. | 16g O2和O3的混合物,含电子8mol | |
| D. | 常温常压下,12g CO和12g N2体积相等 |