题目内容
10.下列关于实验原理或操作的叙述中,不正确的是( )| A. | 纸层析实验中,须将滤纸上的试样点浸入展开剂中 | |
| B. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度不一定要比水大 | |
| C. | 从碘水中提取单质碘时,不能用无水乙醇代替CCl4 | |
| D. | 分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 |
分析 A.纸层析实验中,滤纸上的试样点是不可以浸入展开剂中的,否则试样会溶解在展开剂中;
B.萃取时溶质在不同溶剂中溶解性不同,不能发生反应,不需要考虑密度;
C.乙醇与水互溶;
D.分液时避免上下层液体混合.
解答 解:.纸层析实验中,滤纸上的试样点不能浸入展开剂中,故A错误;
B.萃取时溶质在不同溶剂中溶解性不同,不能发生反应,萃取剂的密度不一定要比水大,故B正确;
C.乙醇与水互溶,则从碘水中提取单质碘时,不能用无水乙醇代替CCl4,故C正确;
D.分液时避免上下层液体混合,则分液漏斗中的下层液体从下口放出,上层液体从上口倒出,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离方法及实验操作、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,选项A为解答的难点,题目难度不大.

练习册系列答案
相关题目
20.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的是( )
| A. |  干燥Cl2 | B. |  分离乙醇和乙酸 | ||
| C. |  石油的蒸馏 | D. |  分离I2 |
1.下列说法不正确的是( )
| A. | 煤是复杂的混合物,含有苯、甲苯、二甲苯等一系列重要的化工原料 | |
| B. | 石油分馏得到的汽油、煤油、柴油等各种沸点范围不同的混合物 | |
| C. | 通过石油裂化和裂解可以获得轻质油和重要化工原料(乙烯、丙烯等) | |
| D. | 天然气和沼气的主要成分是甲烷,它们都属于不可再生能源 |
18.下列分子中,既含有σ键又含有π键的是( )
| A. | CH4 | B. | N2 | C. | HCl | D. | F2 |
5.如图实验操作或装置正确的是( )
| A. |  点燃酒精灯 | B. |  蒸馏 | ||
| C. |  过滤 | D. |  稀释浓硫酸 |
15.如表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp (25℃).
回答下列问题:
(1)由如表分析,若①CH3COOH ②HCO3-③C6H5OH ④H2PO4-均可看作酸,则它们酸性由强到弱的顺序为①④③②(须填编号).
(2)写出C6H5OH与Na3PO4反应的离子方程式:C6H5OH+PO43-=C6H5O-+HPO42-.
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)=c(NH4+)(填“>”、“=”或“<”).
(4)25℃时,向10mL 0.01mol/L苯酚溶液中滴加VmL 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是CD.
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度大于10mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3•H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
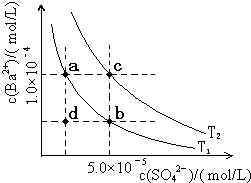 (5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
(5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
①T1< T2(填>、=、<);
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是ABC.
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点.
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| H3BO3 | 5.7×10-10 | ||
| NH3•H2O | NH3•H2O?NH4++OH- | 1.76×10-5 | |
| H2O | Kw=1.0×10-14 | ||
| Mg(OH)2 | Mg(OH)2?Mg2++2OH- | 5.6×10-12 |
(1)由如表分析,若①CH3COOH ②HCO3-③C6H5OH ④H2PO4-均可看作酸,则它们酸性由强到弱的顺序为①④③②(须填编号).
(2)写出C6H5OH与Na3PO4反应的离子方程式:C6H5OH+PO43-=C6H5O-+HPO42-.
(3)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)=c(NH4+)(填“>”、“=”或“<”).
(4)25℃时,向10mL 0.01mol/L苯酚溶液中滴加VmL 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是CD.
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
C.V=10时,混合液中水的电离程度大于10mL 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3•H2O)+2c(NH4+)=c(C6H5O-)+c(C6H5OH)
 (5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
(5)如图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:①T1< T2(填>、=、<);
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是ABC.
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点.
8.表为元素周期表的一部分:
请参照元素①-⑥在表中的位置,用化学用语回答下列问题:
(1)画出元素②的离子结构示意图 .
.
(2)②、③、⑤的离子半径由大到小的顺序为S2->O2->Na+.
(3)元素④和⑥形成的化合物的电子式: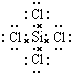 .
.
| 族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ||||
(1)画出元素②的离子结构示意图
 .
.(2)②、③、⑤的离子半径由大到小的顺序为S2->O2->Na+.
(3)元素④和⑥形成的化合物的电子式:
 .
. 
 元素在周期表中的位置,反映了元素的原子结构和元素性质.图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素性质.图是元素周期表的一部分.