题目内容
R、X、Y、M、Z五种短周期主族元素的原子半径依次减小,X、Y、Z的电子层数之和为5,X元素原子的最外层电子数是它的电子层数的2倍,Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,M是地壳中含量最多的元素,R与Z的最外层电子数相同下列叙述正确的是( )
| A、Z与M形成的化合物中不可能含有非极性键 |
| B、对应氢化物的热稳定性:X>Y>M |
| C、单质的还原性:R>M>Y>X |
| D、X、Y、M、Z四种元素组成的离子化合物受热易分解 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:R、X、Y、M、Z五种短周期主族元素的原子半径依次减小,X元素原子的最外层电子数是它的电子层数的2倍,X、Y、Z的电子层数之和为5,则X原子有2个电子层,最外层电子数为4,则X为C元素;Y元素原子的最外层电子数是X元素和Z元素原子最外层电子数的总和,则Z处于第一周期,Y处于第二周期,故Z为H元素,Y最外层电子数为4+1=5,则Y为N元素;M是地壳中含量最多的元素,则M为O元素,R与Z的最外层电子数相同,且原子半径最大,应为Na元素,以此解答该题.
解答:
解:R、X、Y、M、Z五种短周期主族元素的原子半径依次减小,X元素原子的最外层电子数是它的电子层数的2倍,X、Y、Z的电子层数之和为5,则X原子有2个电子层,最外层电子数为4,则X为C元素;Y元素原子的最外层电子数是X元素和Z元素原子最外层电子数的总和,则Z处于第一周期,Y处于第二周期,故Z为H元素,Y最外层电子数为4+1=5,则Y为N元素;M是地壳中含量最多的元素,则M为O元素,R与Z的最外层电子数相同,且原子半径最大,应为Na元素,
A.H、O两元素形成的化合物H2O2,分子中氧原子之间为非极性键,故A错误;
B.非金属:X(C)<Y(N)<M(O),元素的非金属性越强,对应的氢化物越稳定,故B错误;
C.元素的非金属性越强,对应的单质的还原性越弱,M为O元素,对应的单质没有还原性,故C错误;
D.X、Y、M、Z四种元素组成的离子化合物为碳酸铵,铵盐受热易分解,故D正确.
故选D.
A.H、O两元素形成的化合物H2O2,分子中氧原子之间为非极性键,故A错误;
B.非金属:X(C)<Y(N)<M(O),元素的非金属性越强,对应的氢化物越稳定,故B错误;
C.元素的非金属性越强,对应的单质的还原性越弱,M为O元素,对应的单质没有还原性,故C错误;
D.X、Y、M、Z四种元素组成的离子化合物为碳酸铵,铵盐受热易分解,故D正确.
故选D.
点评:本题考查结构物质性质关系、氮化合物性质等,难度中等,推断元素是解题的关键,注意根据最外层电子数之和确定X是推断的突破口.

练习册系列答案
相关题目
一定量的10%的NaOH溶液,若将其蒸发掉100g水后,其质量分数为20%,体积为100mL,则浓缩后的NaOH的物质的量浓度为( )
| A、2.2mol/L |
| B、4mol/L |
| C、5mol/L |
| D、6.25mol/L |
用NA表示阿伏加德罗常数的值.下列说法正确是( )
| A、标准状况下,2.24L二氧化碳中含有共用电子对的数目为0.2NA |
| B、25℃时,pH=12的Na2CO3溶液中含有OH-的数目为0.01NA |
| C、常温常压下,28g乙烯和丙烯的混合气体中含有碳原子的数目为2NA |
| D、0.1mol Cl2与足量铁粉反应转移电子的数目为0.3NA |
下列事故处理方法正确的是( )
| A、凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂 |
| B、制取并用排水法收集氧气结束后,应立即停止加热 |
| C、浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液 |
| D、浓硫酸溅到皮肤上,立即用稀NaOH溶液洗涤 |
下列叙述不正确的是( )
| A、与28 gCO具有相同分子数的C2H4的质量一定是28 g |
| B、1 molAl3+含有的核外电子数为3NA |
| C、常温常压下,1 molL甲烷含有的原子数为5NA |
| D、1 L 1 mol?L-1醋酸溶液中CH3COO+的数目小于NA |
能正确表示下列反应的离子方程式为( )
| A、硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ |
| B、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| C、硫代硫酸钠溶液中滴入稀盐酸:S2O32-+2H+═S↓+SO2↑+H2O |
| D、在NaHSO4溶液中滴加Ba(OH)2至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
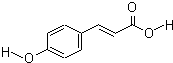 对羟基肉桂酸是一种强效的导电材料,在液晶显示器工业中近年来研究广泛.结构简式如图:
对羟基肉桂酸是一种强效的导电材料,在液晶显示器工业中近年来研究广泛.结构简式如图: