题目内容
19.位于前四周期的6种主族元素A、B、C、D、E、F原子序数依次增大,其中B、D同主族,D、E同周期.A、B、C在周期表中相邻,且三种元素的原子最外层电子数之和为18.F是其所在周期中最活泼的金属元素.根据推断回答下列问题:(1)A在周期表中的位置第二周期、ⅤA族:写出D与F形成的最简单离子化合物的电子式K+
 K+.
K+.(2)用“>”或“<”填空:
| 离子半径 | 非金属性 | 酸性 | 沸点 |
| F+<D2- | A<B | D的最高价氧化物的水化物<E的最高价氧化物的水化物 | C的氢化物>E的氢化物 |
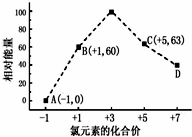
①d点对应的微粒是ClO4-(填离子符号)
②b→a+c反应的离子方程式为3ClO-=ClO3-+2Cl-,该反应是放热反应(填“吸热”或“放热”)
分析 A、B、C在周期表中相邻,且三种元素的原子最外层电子数之和为18,应为同周期相邻元素,且分别位于周期表第ⅤA、ⅥA、ⅦA元素,应分别为N、O、F元素,B、D同主族,则D为S元素,D、E同周期,则E为Cl元素,F是其所在周期中最活泼的金属元素,由元素序数关系可知F为K元素,结合对应单质、化合物的性质以及元素周期率解答该题.
解答 解:A、B、C在周期表中相邻,且三种元素的原子最外层电子数之和为18,应为同周期相邻元素,且分别位于周期表第ⅤA、ⅥA、ⅦA元素,应分别为N、O、F元素,B、D同主族,则D为S元素,D、E同周期,则E为Cl元素,F是其所在周期中最活泼的金属元素,由元素序数关系可知F为K元素,
(1)A为N元素,位于周期表第二周期、ⅤA族,D与F形成的最简单离子化合物为K2S,电子式为K+  K+,
K+,
故答案为:第二周期、ⅤA族;K+  K+;
K+;
(2)K+、S2-具有相同的核外电子排布,核电荷数越大离子半径越小,则离子半径K+<S2-,同周期元素从左到右非金属性逐渐增强,则N<O,因非金属性Cl>S,则S的最高价氧化物的水化物小于Cl的最高价氧化物的水化物,非金属性F>Cl,元素的非金属性越强,对应的氢化物越稳定,则HF>HCl,
故答案为:<;<;<;>;
(3)①由图可知,d中Cl元素的化合价为+7价,则d为ClO4-,故答案为:ClO4-;
②结合Cl元素的化合价可知b→a+c反应为3ClO-=ClO3-+2Cl-,生成1molc时能量变化为3×60kJ-63kJ-0=117kJ,反应物总能量大于生成物总能量,该反应放出117kJ热量,故答案为:3ClO-=ClO3-+2Cl-;放热.
点评 本题考查位置结构性质关系及其应用,为高频考点,侧重对化学用语以及学生分析与迁移应用能力的考查,注意图象的分析与应用,题目难度中等.

| A. | 11种 | B. | 13种 | C. | 14种 | D. | 16种 |
| A. | 甲烷 | B. | 乙烯 | C. | 丙烷 | D. | 苯 |
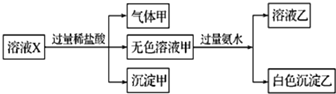
| A. | 气体甲一定是纯净物 | |
| B. | 沉淀甲是硅酸和硅酸镁的混合物 | |
| C. | K+、AlO2-和SiO32-一定存在于溶液X中 | |
| D. | 仅凭以上实验不能确定SO42-是否存在于溶液X中 |
| 阳离子 | Ag+ Ba2+ A13+ |
| 阴离子 | OH- C1- SO42- |
a.B和D都不溶于水,也不溶于酸;
b.A溶于水后,与上述某阳离子反应可生成B,且A溶液与过量氨水反应生成白色沉淀;
c.C溶于水后,与上述某阳离子反应可生成D,且C溶液与过量氨水反应生成白色沉淀;
d.E溶于水后,与上述某阴离子反应可生成B;
e.A溶液与适量E溶液反应生成沉淀,再加入过量E溶液,沉淀量减少,但不消失.
请根据上述实验结果,填空:
(1)写出化合物的化学式:BBaSO4、CAlCl3、DAgCl
(2)写出下列离子方程式
①A溶液与少量的E溶液反应:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓;
②A溶液与过量的E溶液反应:2Al3++3SO42-+3Ba2++8OH-=3BaSO4↓+2AlO2-+4H2O.
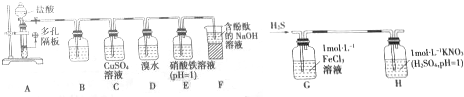
| A. | 将胆矾加热除去结晶水后,称取32 g溶解在1 L水里 | |
| B. | 称取胆矾50 g,溶解在1 L水里 | |
| C. | 将32 g胆矾溶于水,然后将此溶液稀释至1 L | |
| D. | 将50 g胆矾溶于水,然后将此溶液稀释至1 L |
| Ⅰ | Ⅱ | |
| A | 在淀粉KI试纸上滴几滴的FeCl3溶液,试纸变蓝 | 2Fe3++2I-=I2+2Fe2+ |
| B | 铝条置于火焰加热,看到铝熔化欲滴落,却又很快凝固 | 加热时,与O2发生反应,反应吸热 |
| C | 钠投到煤油和水的混合物中,钠粒在分界处作跳动和游动 | 钠的密度比水小比煤油大,能与水反应产生H2 |
| D | 一试管内有2V的Cl2,倒置于水中,在强光充分照射,最后试管中气体变为无色,体积为V | 因为反应Cl2+H2O?HCl+HClO 和2HClO$\stackrel{光照}{?}$2HCl+O2↑ |
| A. | A | B. | B | C. | C | D. | D |
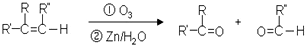
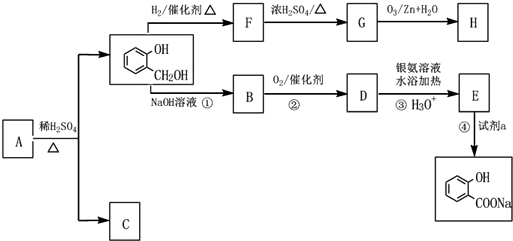
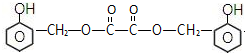 ,C俗称为草酸;
,C俗称为草酸;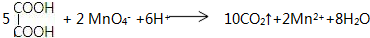 ; 写出C与对苯二甲醇在一定条件下发生缩聚反应的化学反应方程式:
; 写出C与对苯二甲醇在一定条件下发生缩聚反应的化学反应方程式: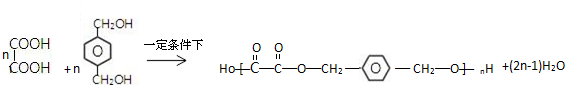 ;
; ;
;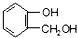 不能发生缩聚反应
不能发生缩聚反应 到F反应是否进行完全,可用FeCl3溶液检验
到F反应是否进行完全,可用FeCl3溶液检验 ;
;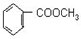 的最佳路线流程图(不参考答案能选用其他任何有机试剂,无机试剂任选). 流程图示例如下:
的最佳路线流程图(不参考答案能选用其他任何有机试剂,无机试剂任选). 流程图示例如下: