题目内容
8.某同学在实验中不小心将几滴新制氯水滴入盛有溴化亚铁溶液的试剂瓶中,发现溶液变成了黄色,根据已有化学知识,请你参与上述现象形成原因的分析与探究:(1)提出问题猜想:
猜想一:溶液呈黄色是因发生离子反应①2Fe2++Cl2=2Fe3++2Cl-(填离子方程式)所致.
猜想二:溶液呈黄色是因发生离子反应②2Br-+Cl2=Br2+2Cl-(填离子方程式)所致.
(2)设计实验并验证
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验.请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
| 试剂 | 酚酞试液、CCl4、无水酒精、KSCN溶液 | ||
| 方案 | 操作步骤 | 实验现象 | 结论 |
| 1 | 取所述黄色溶液于试管中,滴加KSCN溶液并振荡 | 溶液变红色 | 反应①所致 |
| 2 | 取所述黄色溶液于试管中,滴加CCl4并振荡 | 溶液分上下两层,上层为黄色、下层为无色 | |
(4)实验反思
I.根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是溶液分层,上层为黄色、下层为橙红色.
Ⅱ.在100mLFeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1mol/L.
分析 (1)①根据发生氧化还原反应生成Fe3+及Fe3+在水中的颜色来猜想;
②根据溴水的颜色来进行猜想;
(2)利用Fe3+的检验及萃取来进行实验的设计,Fe3+遇KSCN溶液变为红色,溴易溶于四氯化碳中,且四氯化碳与水不溶;
(3)由氧化性Br2>Fe3+,则氯化亚铁溶液中加入1~2滴溴水发生氧化还原反应生成Fe3+;
(4)I.还原性强的离子先被氧化;
Ⅱ.根据电子守恒进行计算.
解答 解:(1)①氧化性:Cl2>Fe3+,则发生2Fe2++Cl2=2Fe3++2Cl-,生成Fe3+且Fe3+在水中为黄色,溶液呈黄色是因为含有Fe3+所致,
②因溴水的颜色为黄色,发生2Br-+Cl2=Br2+2Cl-,则溶液呈黄色是因为含有Br2所致,根据溴水的颜色来进行猜想;
故答案为:2Fe2++Cl2=2Fe3++2Cl-;2Br-+Cl2=Br2+2Cl-;
(2)因Fe3+遇KSCN溶液变为红色,溴易溶于四氯化碳中,且四氯化碳与水不溶,且Fe2+的还原性比Br-强,若溴离子被氧化,溴单质溶解于四氯化碳中,显示橙红色,水和四氯化碳是互不相溶的,三价铁溶解在水中,显示黄色,所以产生的现象是:溶液分上下两层,上层为黄色、下层为无色可知①成立,
故答案为:
| 方案 | 操作步骤 | 实验现象 | 结论 |
| 1 | KSCN溶液 | ① | |
| 2 | CCl4 | 溶液分上下两层,上层为黄色、下层为无色 |
(4)由氧化性Br2>Fe3+,则若在溴化亚铁溶液中滴入足量氯水,亚铁离子、溴均被氧化,再加入CCl4并充分振荡后静止,观察到溶液分层,上层为黄色、下层为橙红色,故答案为:溶液分层,上层为黄色、下层为橙红色;
(5)设FeBr2的物质的量浓度为c,由电子守恒可知,$\frac{2.24L}{22.4L/mol}$×2×1=c×0.1L×(3-2)+c×0.1L×2×$\frac{1}{2}$×(1-0),解得c=1mol/L,
故答案为:1mol/L.
点评 本题考查性质实验方案的设计,为高频考点,涉及氧化还原反应及氧化性、还原性的比较、实验设计等,侧重分析与实验能力的考查,注意物质的性质及氧化还原反应中电子守恒应用,题目难度不大.

练习册系列答案
相关题目
16.下列物质中,属于盐类的是( )
| A. | Na2O | B. | Ca(OH)2 | C. | CaCO3 | D. | H2SO4 |
3.如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列叙述正确的是( )
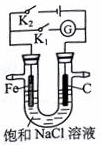

| A. | K1闭合,向铁棒附近滴入K3[Fe(CN)6]溶液,立即有血红色出现 | |
| B. | K2闭合,电流方向由石墨棒经导线流向铁棒 | |
| C. | K2闭合,碳棒上发生还原反应,会生成黄绿色气体 | |
| D. | 将U型管支管封闭并闭合K1一段时间后,U型管中右侧液面会高于左侧液面 |
13.工业上用含有少量氧化铁杂质的废铜粉为原料,制取硫酸铜的主要过程如下图所示:
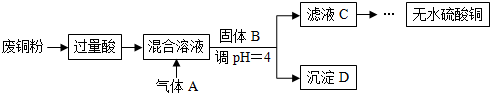
下列有关说法不正确的是( )

下列有关说法不正确的是( )
| A. | “过量酸”不适合用硝酸或浓硫酸,固体B可以用CuO、Cu(OH)2或Cu2(OH)2CO3 | |
| B. | 通入的气体A可以是O2或Cl2 | |
| C. | 通入气体A之前的混合溶液中存在的阳离子是:Fe2+、Cu2+、H+ | |
| D. | 将从溶液中得到的硫酸铜晶体在空气中加热,可制得无水硫酸铜 |
20.下列物质转化关系中,需要加入适当氧化剂的是( )
| A. | HCl→Cl2 | B. | MnO4→Mn2+ | C. | SO3→SO42- | D. | CO2→CO |
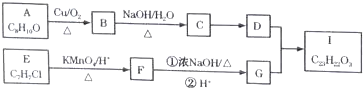
 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$
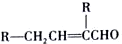
 .
. .
.