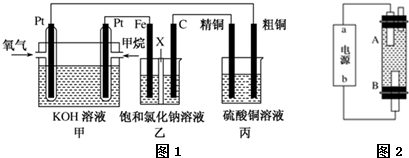
题目内容
2.下列说法正确的是( )| A. | 25℃时,pH=3的CH3COOH溶液加水稀释10倍后,pH=4 | |
| B. | 25℃时,pH=11的NaOH溶液加水稀释100倍后pH=9 | |
| C. | 25℃时,pH=3的盐酸与pH=11的氨水等体积混合后,pH=7 | |
| D. | 90℃时,纯水的pH=6.2,所以加热可以使水呈酸性 |
分析 A.醋酸为弱酸,稀释过程中电离程度增大,则稀释10倍后溶液的pH小于4;
B.强碱溶液稀释100倍后,溶液的pH减小2;
C.氨水为弱碱,混合液中氨水过量,溶液呈碱性;
D.纯水中氢离子与氢氧根离子的浓度相等,为中性.
解答 解:A.醋酸为弱酸,稀释后电离程度增大,则25℃时,pH=3的CH3COOH溶液加水稀释10倍后,溶液的pH<4,故A错误;
B.25℃时,pH=11的NaOH溶液加水稀释100倍后,氢氧化钠为强电解质,则稀释后溶液的pH减小2,稀释后溶液的pH=9,故B正确;
C.25℃时,pH=3的盐酸与pH=11的氨水等体积混合后,氨水为弱碱,则混合液中氨水过量,溶液的pH>7,故C错误;
D.90℃时,纯水的pH=6.2,但水中氢离子与氢氧根离子浓度相等,呈中性,故D错误;
故选B.
点评 本题考查了溶液酸碱性与溶液pH的计算,题目难度中等,明确弱电解质的电离平衡及其影响为解答关键,注意掌握溶液酸碱性与溶液pH的关系及计算方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
12.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,22.4L SO3中含有的分子数为NA个 | |
| B. | 标准状况下,2.24 L NH3和CH4的混合气体,所含电子总数为2NA | |
| C. | 7.1 g Cl2与足量的铁反应转移的电子数目是0.3NA | |
| D. | 1 mol C5H12分子中共价键总数为16NA |
13.工业上用含有少量氧化铁杂质的废铜粉为原料,制取硫酸铜的主要过程如下图所示:
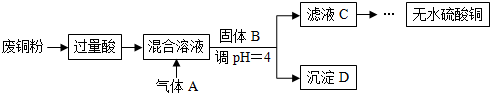
下列有关说法不正确的是( )

下列有关说法不正确的是( )
| A. | “过量酸”不适合用硝酸或浓硫酸,固体B可以用CuO、Cu(OH)2或Cu2(OH)2CO3 | |
| B. | 通入的气体A可以是O2或Cl2 | |
| C. | 通入气体A之前的混合溶液中存在的阳离子是:Fe2+、Cu2+、H+ | |
| D. | 将从溶液中得到的硫酸铜晶体在空气中加热,可制得无水硫酸铜 |
10.在无色透明的强酸性溶液中,能大量共存的离子组是( )
| A. | K+、Cu2+、NO3-、SO42-- | B. | K+、Na+、Cl-、SiO32- | ||
| C. | Al3+、NH4+、NO3-、Cl- | D. | K+、Na+、AlO2-、Cl |
7.以下互为同位素的是( )
| A. | 13C与14N | B. | D2与H2 | C. | O2与O3 | D. | 35Cl与37Cl |
14.人体血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化Fe3+而中毒,服用维生素C可以解毒.对上述的分析正确的是( )
| A. | 亚硝酸盐是还原剂 | B. | 维生素C是氧化剂 | ||
| C. | 维生素C被氧化 | D. | 亚硝酸盐发生氧化反应 |
11.下列有关电解质溶液的说法正确的是( )
| A. | 在蒸馏水中滴加浓H2SO4,Kw不变 | |
| B. | CaCO3不易溶于稀硫酸,也不易溶于醋酸 | |
| C. | NaCI溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| D. | 在Na2S稀溶液中,c(H+)=c( OH-)-2c(H2S)-c(HS-) |