题目内容
3.800℃时,反应CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数K=1,现向某一密闭容器中充入1.2molCO和0.6mol H2O(g)发生反应,一定时间后达到化学平衡状态,保持温度不变,下列说法正确的是( )| A. | 再充入等物质的量的CO2和H2达到新的平衡状态,CO的体积分数不变 | |
| B. | 再向容器中再充入1molCO,平衡正向移动,H2的体积分数增大 | |
| C. | 若起始时充入1.2mol H2O(g)和0.6mol CO,达到平衡时H2的体积分数不变 | |
| D. | 若起始时充入0.9mol H2O(g)、0.6mol CO、0.7mol CO2和0.8molH2,则此时υ正=υ逆 |
分析 800℃时,平衡常数K=1,设转化的CO为x,则
CO(g)+H2O(g)?CO2(g)+H2(g)
开始 1.2 0.6 0 0
转化 x x x x
平衡 1.2-x 0.6-x x x
则$\frac{x×x}{(1.2-x)(0.6-x)}$=1,
解得x=0.4,
A.再充入等物质的量的CO2和H2达到新的平衡状态,极限转化为反应物时,CO、H2O的物质的量比不是2:1;
B.再向容器中再充入1molCO,平衡正向移动,但总物质的量增大;
C.若起始时充入1.2mol H2O(g)和0.6mol CO,K不变,生成氢气仍为0.4mol,且总物质的量不变;
D.Qc=$\frac{0.7×0.8}{0.9×0.6}$>K,平衡逆向移动.
解答 解:800℃时,平衡常数K=1,设转化的CO为x,则
CO(g)+H2O(g)?CO2(g)+H2(g)
开始 1.2 0.6 0 0
转化 x x x x
平衡 1.2-x 0.6-x x x
则$\frac{x×x}{(1.2-x)(0.6-x)}$=1,
解得x=0.4,
A.再充入等物质的量的CO2和H2达到新的平衡状态,极限转化为反应物时,CO、H2O的物质的量比不是2:1,则CO的体积分数与原平衡不同,故A错误;
B.再向容器中再充入1molCO,平衡正向移动,但总物质的量增大,则H2的体积分数可能减小,故B错误;
C.若起始时充入1.2mol H2O(g)和0.6mol CO,K不变,生成氢气仍为0.4mol,且总物质的量不变,则达到平衡时H2的体积分数不变,故C正确;
D.Qc=$\frac{0.7×0.8}{0.9×0.6}$>K,平衡逆向移动,则此时υ正<υ逆,故D错误;
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、平衡移动、Qc与K的关系为解答的关键,侧重分析与计算能力的考查,注意选项A为解答的难点,题目难度不大.

| A. | “雨后彩虹”是与胶体、光学等知识有关的自然现象 | |
| B. | “百炼成钢”主要发生了物理变化 | |
| C. | “返青粽叶”指的是添加胆矾(CuSO4•5H2O)后的粽叶青绿新鲜,长期食用有害健康,其中胆矾是混合物 | |
| D. | “明矾净水”与漂白粉用于自来水消毒的原理相同 |
| A. | 酒精和水 | B. | 碘和四氯化碳 | C. | 水和四氯化碳 | D. | 混有泥土的蔗糖 |
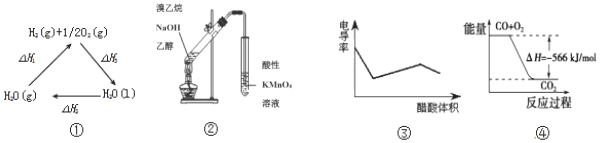
| A. | 图①中△H1=△H2+△H3 | |
| B. | 图②可用于证明实验中生成了乙烯 | |
| C. | 图③表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 | |
| D. | 图④可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量 |
| A. | 第一电离能:F>O>N | |
| B. | 离子晶体中一定存在离子键 | |
| C. | CCl4和NH3都是以极性键结合的极性分子 | |
| D. | 白磷为分子晶体,分子结构为正四面体,其键角为109.5° |
| A. | CO+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO2 | B. | CaCO3+H2O+CO2═Ca(HCO3)2 | ||
| C. | CuO+2HCl═CuCl2+H2O | D. | NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ |
| A. | 3:2:4:1 | B. | 1:1:1:1 | C. | 2:1:2:1 | D. | 1:2:1:2 |
| A. | 标准状况下,11.2LCH3Cl含极性共价键数目为2NA | |
| B. | 0.1L 1.0mol/L Na2S溶液中S2-和HS-总数为0.1NA | |
| C. | 22.4g 铁粉与稀硝酸完全反应时转移的电子数一定为1.2NA | |
| D. | 常温常压下,16g14CH4中所含电子数目为8NA |